微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4CL晶体,并用玻璃棒快速搅拌。
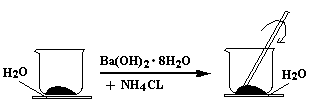
(1)实验中要用玻璃棒搅拌的原因是 。
(2)写出该反应的化学方程式 。
该反应 (填“是”或“不是”)氧化还原反应。
(3)该实验的现象有 。
(4)该反应为 (填“吸”或“放”)热反应,这是由于反应物的总能量 (填“大于”或“小于”)生成物的总能量。
参考答案:(1)该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
(2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 不是
(3)玻璃片上因结冰而与小烧杯粘在一起,同时有刺激性气味的气体产生
(4)吸 小于
本题解析:(1)因为反应物都是固体,即这是固体间的反应,所以通过玻璃棒的搅拌可使混合物充分接触并发生反应。
(2)在反应中元素的化合价并没有发生变化,所以不是氧化还原反应。
(3)因为反应是吸热反应,所以会导致温度降低,因而还会结冰,同时有氨气释放出来,所以还会闻到有刺激性气味的气体产生。
(4)根据谢谢可知反应是吸热的,这说明反应物的总能量小于生成物的总能量。
本题难度:一般
2、填空题 (4分)(1)下列反应中,属于放热反应的是 ,属于吸热反应的是 。
①燃烧反应②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳
⑤食物因氧化而腐败⑥Ba(OH)2·8H2O与NH4Cl反应⑦铁粉与稀盐酸反应
(2)写出(1)中⑥的化学方程式 。
参考答案:(1)①②③⑤⑦ ④⑥ (2)Ba(OH)2·8H2O +2NH4Cl ==BaCl2 +2NH3 +10H2O
本题解析:略
本题难度:一般
3、填空题 下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
(12分)
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为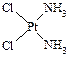 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为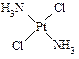 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是?▲?;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式:?▲?。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:?▲?。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有?▲?个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为?▲?(必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了?▲?杂化。
参考答案:⑴O>N>C ?1s22s22p63s23p63d84s2?⑵顺铂易溶于水,因为它是极性分子,易溶于极性溶剂?⑶4?⑷①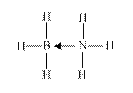 ?②sp3和sp2
?②sp3和sp2
本题解析:⑴非金属性越强,电负性越大;结合元素的原子序数、元素在周期表中的位置等可以很方便地确定其外围电子排布,进而书写原子核外电子排布式。⑵物质的溶解性多数符合“相似相溶”的规律。⑶金属铂的晶胞中含有铂原子数为8×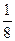 +6×
+6×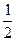 =4。?⑷第二周期中与乙烷互为等电子体的气态氢化物不存在,应该由两个碳原子联想到一个氮原子和一个硼原子组成与乙烷相似的氢化物。其中B原子提供空轨道,N原子提供孤对电子;根据等电子体的结构相似,X、Y中氮原子、硼原子的轨道杂化方式与乙烯、乙炔中的碳原子均相同。说明:Y的结构简式为H2B=NH2。
=4。?⑷第二周期中与乙烷互为等电子体的气态氢化物不存在,应该由两个碳原子联想到一个氮原子和一个硼原子组成与乙烷相似的氢化物。其中B原子提供空轨道,N原子提供孤对电子;根据等电子体的结构相似,X、Y中氮原子、硼原子的轨道杂化方式与乙烯、乙炔中的碳原子均相同。说明:Y的结构简式为H2B=NH2。
本题难度:一般
4、选择题 下列各物质中含既有离子键又有共价键的是( )
A.CO2
B.NaCl
C.CuSO4
D.HNO3
参考答案:A、CO2属于共价化合物,所含化学键为非金属原子之间的作用力,为共价键,故A错误;
B、NaCl为离子化合物,只含有离子键,不存在共价键,故B错误.
C、硫酸铜是离子化合物,铜离子和硫酸根离子之间存在离子键,硫酸根离子中硫原子和氧原子之间存在共价键,故C正确.
D、HNO3是共价化合物,只含共价键,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 A2+B2===2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2==="A" +A △H 1 Ⅱ.B2==="B" +B △H 2 Ⅲ.A+B===AB △H 3
则下列说法中正确的是( )
A.当△H3+(△H1+△H2) >0时,该反应是吸热反应;
B.当 2△H3+(△H1+△H2) > 0时,该反应是放热反应;
C.当 2△H3+(△H1+△H2 ) <0时,该反应是放热反应;
D.当1/2△H3+(△H1+△H2)<0时,该反应是吸热反应;