|
高考化学知识点整理《气体的净化、干燥、吸收与收集》试题强化练习(2017年最新版)(四)
2017-07-31 23:45:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。已知:2Na2CO3+3H2O2=2Na2CO3·3H2O2 ?△H<0;回答下列问题:
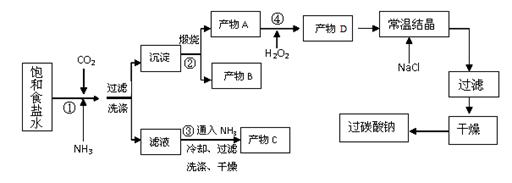
(1)下列物质可使过碳酸钠较快失效的是(填序号)?。?
A.FeCl3溶液
B.H2S
C.稀硫酸
D.NaHCO3溶液
| (2)已知产物C是一种常用氮肥,则其化学式为?,
反应①的总反应方程式为?。
(3)该生产流程中可循环使用的物质是?。
(4)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是? 。
参考答案:(共8分)
(1)C(3分)
(2)NH4Cl (1分)? NaCl+CO2+H2O+NH3=NaHCO3 ↓+NH4Cl(2分)
(3)CO2(1分)
(4)晶体的洗涤(1分)
本题解析:(1)根据碳酸钠或双氧水的化学性质分析;
(2)根据双氧水的不稳定性分析;(3)根据化学方程式的计算格式及步骤以及溶质质量分数的计算公式分析解答。①发生的反应方程式为:NaCl+CO2+H2O+NH3=NaHCO3 ↓+NH4Cl,则C为NH4Cl。
(3)经过分析反应的流程可以得出生产流程中可循环使用的物质是CO2。
(4)如果最后没有晶体的洗涤,产品纯度会偏低。
具体解答:(1)导致碳酸钠变质的原因是与碳酸钠或双氧水反应了,A、加入FeCl3溶液,使双氧水分解而变质;B加入H2S,与双氧水反应而变质;C加入稀硫酸,与碳酸钠反应而变质; D加入NaHCO3溶液,与碳酸钠或双氧水不反应,不变质;故选A、B、C。
(2)
点评:本题考查了双氧水、碳酸钠的化学性质及有关溶液及化学方程式的计算,注重考查学生的分析能力和基本计算能力。
本题难度:一般
2、实验题 (14分)实验是进行化学研究的重要手段之一。请完成下列问题。
(1)下面A~E是中学化学实验中常见的几种实验装置。
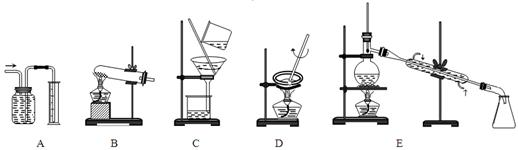
请为进行下列实验挑选合适的装置(填序号字母)
①量气装置是?;②过滤装置是?;
③蒸发装置是?;④I2的CCl4溶液中提取I2选用?。
(2)下列实验操作,不正确的是________
a.用纸槽往试管里装粉末状药品时,试管应先横放再直立
b.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
(3)实验室需要450 mL 0.1 mol/LNaOH溶液和500 mL 0.5 mol/L硫酸溶液。请回答下列问题。
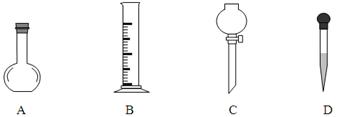
①在下图所示仪器中,配制上述溶液肯定不需要的是?,(填序号)除图中已有仪器外,配制上述溶液还需要的玻璃仪器有?。
②配制450 mL 0.1 mol/L NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为?g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为?。(填序号)
参考答案:(14分)
(1)A(1分)? C(1分)? D(1分)? E(1分)
(2)bcd(2分)
(3)①AC(2分)?烧杯、玻璃棒、500 mL容量瓶(2分,每少一种扣1分)
②2.0(2分)? abdcfe(2分)
本题解析:
(1)A装置是排水量气装置,B装置是固体加热反应装置,C装置是过滤装置,D装置是蒸发液体装置,E装置是蒸馏装置。
(2)因为氢氧化钠具有腐蚀性和易潮解性质,称量时应该放入小烧杯或表面皿中称量;量筒不能加热、试管可以直接加热;试纸应该用镊子夹住靠近气体,不能用手直接去拿试纸。
(3)配制氢氧化钠和硫酸需要用到托盘天平、量筒、500 mL容量瓶、滤纸、烧杯、玻璃棒、胶头滴管等仪器,不需要平底烧瓶和分液漏斗,还缺少烧杯、玻璃棒、500 mL容量瓶;根据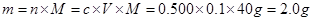 ,不能用450mL的体积来计算,因为没有这个容积的容量瓶。根据溶液配制的步骤:一算(计算)、二称(称量)、三溶(溶解)、四转(转移)、五洗(洗涤)、六定(定容)、七摇(摇匀)、八装(装瓶)、九贴(贴标签)。应该是abdcfe。 ,不能用450mL的体积来计算,因为没有这个容积的容量瓶。根据溶液配制的步骤:一算(计算)、二称(称量)、三溶(溶解)、四转(转移)、五洗(洗涤)、六定(定容)、七摇(摇匀)、八装(装瓶)、九贴(贴标签)。应该是abdcfe。
点评:实验是学生答题易失分点,虽然本题属于基础题,但对于学生仍然是难点。
本题难度:一般
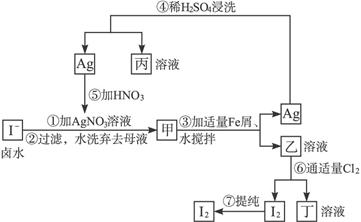
3、填空题 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
试完成下列问题:
(1)乙、丁中溶质的化学式:乙____________;丁____________。
(2)第④步操作中用稀H2SO4浸洗的目的是____________(填写字母编号)。
a.除去未反应的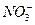 ? b.除去未反应的I- ? b.除去未反应的I-
c.除去未反应的Fe? d.除去碱性物质
(3)第⑦步操作可供提纯I2的一种方法是____________(不要求写具体步骤)。
(4)实验室检验I2的方法是________________________。
(5)甲物质见光易变黑,其原因是______________________________(用化学方程式表示)。
参考答案:(1)FeI2? FeCl3? (2)c? (3)升华或萃取? (4)将I2加到淀粉溶液中,溶液显蓝色?(5)2AgI 2Ag+I2 2Ag+I2
本题解析:富碘卤水中的I-与Ag+反应生成AgI(甲),AgI、铁粉在水中经不断搅拌,会缓慢发生反应,生成Ag和FeI2(即物质乙),在第④步加入稀H2SO4是溶解多余的铁粉而提纯银,再把银溶于硝酸,制取AgNO3,重新与I-反应。而乙溶液中通入适量Cl2,可生成FeCl3溶液(丁)和I2单质,用升华或萃取的办法提纯碘。
点评:本题考查了卤素及其化合物的特性、X-(卤离子)的检验等知识,考查了学生综合运用知识的能力。
可运用平衡移动的观点解释AgI、铁粉在水中的反应:AgI(s) Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。 Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。
本题难度:简单
4、选择题 实验室制取1 mL乙酸乙酯后,沿壁器加入0.5 mL紫色石蕊试液,这时石蕊试液将存在于饱和碳酸钠层和乙酸乙酯层之间(整个过程不振荡试管),对可能出现的现象,叙述正确的是( )
A.液体分两层,石蕊层仍为紫色,有机层呈无色
B.石蕊层为三层环,由上而下是蓝、紫、红色
C.石蕊层有两层,上层为紫色,下层为蓝色
D.石蕊层为三层环,由上而下是红、紫、蓝色
参考答案:D
本题解析:乙酸密度小于水的,而乙酸显酸性,所以上层显红色。碳酸钠在最下面,显碱性,遇石蕊试液显蓝色,中间是紫色的石蕊试液,答案选D。
本题难度:一般
5、选择题 实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是

A.HCl
B.Cl2
C.CO
D.NH3
参考答案:D
本题解析:略
本题难度:简单
|