微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是(? )。
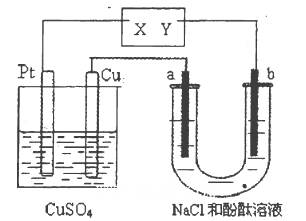 ?
?
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小
D.CuSO4溶液的pH减小
参考答案:B
本题解析:该装置为电解装置,a极显红色,说明a极氢氧根离子浓度增大,氢离子浓度减小,所以a极氢离子放电,则a极为阴极,b极为阳极,Y为正极X为负极,A错误;B正确;因此铂极为阴极,铜离子放电成为单质铜,铜极为阳极,铜放电成为铜离子进入溶液,所以CuSO4溶液的浓度基本不变,pH基本不变,C、D错误,答案选B。
本题难度:简单
2、选择题 以石墨作阴极,铜作阳极电解饱和NaCl溶液,电解开始约30s,阳极附近略显白色浑浊,然后开始出现橙黄色浑浊,进而生成较多的橙黄色沉淀。下列说法正确的是
A.阳极:Cu – 2e- = Cu2+
B.水被电解后析出白色浑浊物NaCl
C.橙黄色浑浊是CuCl
D.橙黄色沉淀可以用氨水溶解
参考答案:C
本题解析:略
本题难度:简单
3、填空题 从?H+、Cu2+、Na+、SO42-、Cl-中选择适当的离子组成电解质,使之符合下列要求.
(1)以石墨棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是______.
(2)以石墨棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是______.
(3)以石墨棒为阳极,铁棒为阴极,电解时电解质和水量都减少,应选用的电解质是______.
参考答案:因阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-,
则(1)惰性电极电解CuCl2溶液时,铜离子、氯离子放电,则电解质质量减小,水量不变,故答案为:CuCl2;
(2)惰性电极电解H2SO4(或Na2SO4)溶液时,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故答案为:H2SO4(或Na2SO4);
(3)石墨棒为阳极,铁棒为阴极,电解CuSO4(或NaCl)溶液时,则铜离子、氢氧根离子(或氯离子、氢离子)放电,所以电解质和水量都减少,故答案为:CuSO4(或NaCl).
本题解析:
本题难度:一般
4、选择题 如图所示,电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下表中说法正确的是

?
| 电极材料
| 通电后的变化
|
阴极
| 阳极
|
A
| 石墨
| 石墨
| 阴极质量增加,溶液的pH增大
|
B
| 铜
| 铜
| 阳极质量减小,阴极质量增加
|
C
| 铁
| 铁
| 两极的质量不发生变化
|
D
| 铂
| 铁
| 阴极质量增加,溶液的浓度不变
参考答案:B
本题解析:若用石墨作为电极电解硫酸铜溶液,则阳极OH-放电产生氧气,溶液的碱性减弱,pH降低;阴极Cu2+放电析出铜,A不正确。若用铜电极电解硫酸铜溶液,类似于粗铜的提纯,选项B正确。若用铁电极电解硫酸铜溶液,阴极Cu2+放电析出铜,阳极铁失去电子而溶解,C不正确。若用铂作阴极,铁作阳极电解硫酸铜溶液,仍然是阴极Cu2+放电析出铜,阳极铁失去电子而溶解,但溶液中Cu2+浓度减小,Fe2+增大,D也不正确。
本题难度:一般
5、选择题 下列表示对应化学反应的离子方程式正确的是
A.粗铜精炼时,与电源正极相连的是粗铜,该电极反应式只有:Cu —2e-= Cu2+
B.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
C.氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:
|
NH4++Al3++2SO42-+2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O
参考答案:D
本题解析:A、精炼粗铜时,与电源正极相连的是粗铜,因为粗铜中含有铁、锌杂质,所以还会发生Fe-2e-=Fe2+等反应,错误;B、酸性溶液中的生成物不可能是氢氧根离子,离子方程式应为5I-+IO3-+6H+=3I2+3H2O,错误;C、电荷不守恒,错误;D、0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合,则后者物质的量是前者的2倍,硫酸根离子完全沉淀,铝离子与氢氧根离子反应生成氢氧化铝沉淀,铵根离子与氢氧根离子反应生成一水合氨,正确,答案选D。
考点:考查离子方程式书写正误的判断
本题难度:一般