微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是?
A.1mol/L的NaCl溶液是指此溶液中含有1mol NaCl
B.从1 L 0.5 mol/L,的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 mol/L,
C.25℃、1atm时,1molCl2的体积约为22.4L
D.50ml、l mol/L的CaCl2溶液和100ml、2 mol/L的NaCl溶液中的Cl-的物质的量浓度相同.
参考答案:D
本题解析:略
本题难度:一般
2、填空题 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)需量取浓H2SO4的体积为
(2)如果实验室有20mL、50mL、100mL量筒,应选用 mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(3)将稀释并冷却后的硫酸溶液沿 注入 中,并用蒸馏水洗涤__________2~3次,洗涤液要 中,并摇匀。
(4)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平。
参考答案:(10分 除注明外每空1分)(1)14ml (2)10 偏低
(3)玻璃棒 500ml容量瓶(2分) 烧杯和玻璃棒 注入容量瓶 (4)1~2cm 胶头滴管
本题解析:(1)浓H2SO4的物质的量浓度c=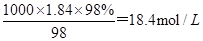 。根据稀释定律,稀释前后溶质的物质的量不变,所以若设浓硫酸的体积为xmL,则xmL×18.4mol/L=500mL×0.5mol/L,解得x=13.6ml。
。根据稀释定律,稀释前后溶质的物质的量不变,所以若设浓硫酸的体积为xmL,则xmL×18.4mol/L=500mL×0.5mol/L,解得x=13.6ml。
(2)由(1)可知所以应量取的浓硫酸体积是13.6mL,故选20mL量筒。量筒用水洗净后直接量取,未用浓硫酸润洗,即相当于是稀释浓硫酸,所以所配制的硫酸浓度偏低。
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用托20mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀即可。
(4)定容时加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
考点:考查一定物质的量浓度溶液的配制
点评:该题是高考中的常见题型,属于基础性实验题的考查,有利于培养学生规范严谨的实验设计能力和动手操作,有利于调动学生的学习兴趣,激发学生的学习积极性。答题时注意理解配制原理,注意浓硫酸的稀释操作。
本题难度:一般
3、选择题 VmLAl2(SO4)3溶液中含有Al3+ag,取0.5VmL溶液稀释到4VmL,则稀释后溶液中S042-的物质的量浓度是( )
A.
mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:ag Al3+的物质的量为ag27g/mol=a27mol,
故0.5VmL溶液中Al3+的物质的量为a27mol×0.5VmLVmL=a54mol,
根据电荷守恒可知2n(SO42-)=3n(Al3+),故0.5VmL溶液中SO42-的物质的量为a54mol×32=a36mol,
0.5VmL溶液稀释到4VmL,则稀释后溶液SO42-的物质的量浓度为a36mol4V×10-3L=125a18Vmol/L,
故选B.
本题解析:
本题难度:简单
4、选择题 0.5LAlCl3溶液中含Cl—9.03×1023个,则溶液物质的量浓度是 ( )
A.0.1mol/L
B.1mol/L
C.3mol/L
D.1.5mol/L