微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 取100mL?0.3mol/L和300mL?0.25mol/L的硫酸混合后加水配制成500mL溶液,该混合溶液中H+的物质的量浓度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.24mol/L
参考答案:B
本题解析:分析:先利用n=cV来计算每份硫酸溶液中硫酸的物质的量,从而计算出H+的物质的量,再利用混合后溶液的体积及c= 来计算H+的物质的量浓度.
来计算H+的物质的量浓度.
解答:100mL0.3mol/L硫酸溶液中硫酸的物质的量为0.1L×0.3mol/L=0.03mol,
300mL0.25mol/L的硫酸溶液中硫酸的物质的量为0.3L×0.25mol/L=0.075mol,
则混合后硫酸的物质的量为0.03mol+0.075mol=0.105mol,
H+的物质的量为0.105mol×2=0.21mol,
则该混合溶液中H+的物质的量浓度为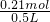 =0.42mol/L,
=0.42mol/L,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、溶液的体积、浓度之间的关系及硫酸与氢离子的关系即可解答,难度不大.
本题难度:简单
2、选择题 下列叙述中,正确的是
[? ]
A.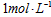 的
的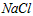 溶液表示:1L溶液中含有
溶液表示:1L溶液中含有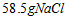
B.用天平称取
C.用 的量筒量取
的量筒量取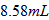 浓盐酸
浓盐酸
D.配制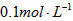 的硫酸溶液时,将量取的浓硫酸放入容量瓶中加入水稀释
的硫酸溶液时,将量取的浓硫酸放入容量瓶中加入水稀释
参考答案:A
本题解析:
本题难度:简单
3、计算题 (5分)用14.2g无水Na2SO4配制成500mL溶液,其物质的量浓度为多少?若从中取出10mL,含溶质Na2SO4的质量是多少克?
参考答案:
本题解析:略
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.1molFe(OH)3胶体中含有NA个胶粒
B.常温下,5.6g铁与足量的盐酸反应,失去电子数为0.3NA
C.标准状况下,11.2L SO2所含的分子数为0.5NA。
D..在20℃,1.01×105Pa时,2.8g C2H4和CO的混合气体,含气体分子数0.1NA