微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将含有amolNa2SO3的溶液跟含有bmolNa2S的溶液混合后无明显现象。若再加入稀H2SO4,则立即出现浅黄白色硫沉淀。有关叙述不正确的是
A.若a∶b>1∶2,生成S和SO2
B.若a∶b=1∶2,生成S而无SO2
C.若a∶b<1∶2,生成S和H2S
D.若a∶b≤1∶3,生成S、SO2、H2S
参考答案:D
本题解析:S2-与SO32-在非酸性环境中难以反应,所以Na2SO3与Na2S溶液混合无明显现象,加酸对氧化剂SO32-的氧化性起加强作用,因而即发生氧化还原反应:2Na2S+Na2SO3+3H2SO4=3S↓S+3Na2SO4+3H2O。
按上反应方程式,Na2SO3与Na2S物质的量之比为1∶2,只析出S。在加入足量硫酸的前提下,若Na2S过量,即a∶b<1∶2,则Na2S与H2SO4反应逸出H2S;若Na2SO3过量,即a∶b>1∶2,则H2SO4与Na2SO3反应逸出SO2。但总不会同时逸出H2S和SO2,因为它们也会反应(2H2S+SO2=3S↓+2H2O)。
本题难度:简单
2、选择题 标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是( )
A.所得沉淀为0.05 mol的BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672<a<0.896
参考答案:C
本题解析:将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。主要发生了:1 二氧化硫与氯气在水溶液中的氧化还原反应且两者按物质的量之比1:1进行;2、由于溶液的棕黄色变浅,知前者反应物二氧化硫过量继而发生了二氧化硫与三价铁离子的氧化还原反应,且二者按物质的量之比1:2进行。再据向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g,知沉淀为硫酸钡且是0.05摩尔,故A正确;同时知溶液中硫酸根总量为0.05摩尔,其中来自于硫酸铁0.03摩尔,那么另外0.02摩尔硫酸根肯定来自于二氧化硫的氧化产物,由此推知有0.02摩尔二氧化硫被氧化,标况下0.448升,即B正确;当溶液中所有的三价铁离子全部被还原时,(即0.02摩尔三价铁)需要二氧化硫0.01摩尔,那么其余0.01摩尔二氧化硫参与了和氯气的反应,并消耗氯气0.01摩尔,这样看来a L混合气体的物质的量为0.03mol时,即0.672升时反应恰好完成,只要二氧化硫大于0.01摩尔即混合气体体积大于0.448升时即合题意,C D不正确。
本题难度:一般
3、选择题 已知乙烯能使酸性高锰酸钾溶液褪色,下列褪色原理与其一致的是( )
A.SO2使品红溶液褪色
B.乙烯使溴水褪色
C.SO2使溴水褪色
D.甲烷使氯气褪色
参考答案:C
本题解析:乙烯能使酸性高锰酸钾溶液褪色是被氧化,发生的是氧化还原反应。A.SO2使品红溶液褪色发生的是结合漂白,错误;B.乙烯使溴水褪色发生的是加成反应,错误;C.SO2使溴水褪色发生的是氧化还原反应,正确;D.甲烷使氯气褪色发生的是取代反应,错误。
本题难度:一般
4、实验题 (1)将一束灼热的细铜丝立刻放进盛有氯气的集气瓶中,产生的现象是?,反应的方程式是?。若将一束擦亮的细铜丝伸进装有硫蒸气的大试管内,产生的现象是?,反应的方程式是?,由此得出Cl2与S的氧化性比较是?。
(2)某学生在做铜丝在硫蒸气中燃烧的实验时,先将铜丝用砂纸磨光,在酒精灯上预热后迅速插入试管内靠近熔化的硫的液面上方,结果未见铜丝燃烧。实验失败的可能原因是:①?,②?。
(3)汞蒸气有毒。①万一把汞洒出,可以在溅洒有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是:?。②室内有汞蒸气时,应进行通风以降低汞蒸气浓度,这时通风口装在墙的?(填“上”或“下”)部的效率高。
(4)举出两个实验事实,说明氧的非金属性比氟弱:①?;②?。
参考答案:(1)棕黄色的烟? Cu+Cl2  ?CuCl2?燃烧生成黑色的固体? 2Cu+S
?CuCl2?燃烧生成黑色的固体? 2Cu+S  ?Cu2S? Cl2>S
?Cu2S? Cl2>S
(2)①铜丝预热时表层生成的CuO隔绝了铜与硫蒸气的接触?②熔化的硫未达到沸腾,S蒸气的浓度小,温度低
(3)①Hg+S  ?HgS?②下
?HgS?②下
(4)①F2与H2在暗处化合,O2与H2要点燃才化合?②F2与水反应:2F2+2H2O  ?4HF+O2,H2O中-2价的氧被F2氧化生成O2
?4HF+O2,H2O中-2价的氧被F2氧化生成O2
本题解析:(1)Cu在Cl2中燃烧生成固体小颗粒CuCl2,Cu在S蒸气中燃烧生成Cu2S。(2)应考虑S蒸气的浓度大小、反应温度等因素。(3)由于汞在常温下可与S反应,故可用此法消除少量汞引起的污染。汞的相对原子质量为200.6,远大于空气的平均相对分子质量29,所以汞蒸气的密度大于空气,在室内的下部空间存在。(4)根据氟气、氯气与氢气化合的难易、反应条件及反应的剧烈程度设计实验,此外,F2与H2O反应可以置换出氧而产生氧气。
本题难度:简单
5、实验题 分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为?,?
(2)装置C的直玻管中发生的反应的化学方程式为?,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是?,
(4)装置E中NaOH的作用是?,反应的离子方程式为?;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________;? __________________________________。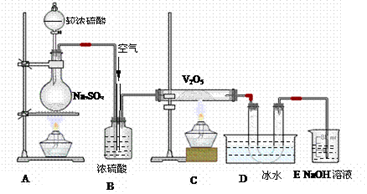
参考答案:(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2,(2)2SO2+O2==2SO3,
(3)吸收尾气,SO2+2OH-=SO32-+2H2O;
(4)与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1);干燥气体
本题解析:该实验装置图为在A产生了二氧化硫,气体在B中被干燥,然后二氧化硫和氧气在五氧化二钒催化加热下生成了三氧化硫,三氧化硫的凝固点很低,在D中被凝结,E为除去还没有反应的二氧化硫,所以(1)装置A的烧瓶中发生的反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2,(2)装置C的直玻管中发生的反应的化学方程式为:2SO2+O2==2SO3,(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是SO3;(4)装置E中NaOH的作用是吸收尾气,其反应的离子方程式为SO2+2OH-=SO32-+2H2O;(5)B装置的作用很多,可以用来混合气体,也可以与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1);干燥气体。
点评:本题考查了三氧化硫的制备实验,解答该题的关键是要分析该题的各个小装置作用,本题有利于培养学生分析实验的能力,该题难度适中。
本题难度:一般