微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关SO2说法错误的是(?)
A.单质硫在空气中燃烧可生成SO2
B.SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色
C.SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用
D.SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应
参考答案:C
本题解析:B项由于二氧化硫的漂白是暂时性漂白,漂白以后生成的无色物质不稳定,受热又能恢复,B项正确;C项由于SO2+ Cl2+2H2O=H2SO4+2HCl,不但没有增强反而减弱漂白性,C项错误;D二氧化硫是酸性氧化物所以能和碱溶液反应。
本题难度:一般
2、选择题 下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生成的
是( )
A.NaHCO3和Al(OH)3
B.BaCl2和NaCl
C.KClO3和K2SO4
D.Na2SO3和BaCO3
参考答案:D
本题解析:A项中两种物质均与H2SO4反应,但只产生气泡;B项中只有BaCl2与H2SO4反应,生成BaSO4、HCl,只产生沉淀;C项中两种物质均不与H2SO4反应;D项中两种物质均与H2SO4反应,既产生气泡又有沉淀生成。
本题难度:一般
3、选择题 为了不使环境受到污染,下列各组中的两种物质可以同时倒入废液缸内的是()
A.Na2S溶液和盐酸
B.KMnO4溶液和盐酸
C.浓硫酸和Na2SO3
D.盐酸和NaHCO3
参考答案:D
本题解析:A中产生H2S,B中产生Cl2,C中产生SO2,均是大气污染物;D中产生CO2,可直接排入空气中。
本题难度:简单
4、选择题 将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应现象:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
参考答案:B
本题解析:A、二者分别生成红棕色气体、无色气体,前者反应更剧烈,错误;B、Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+4H2O中1molCu消耗4molHNO3,而3Cu+8HNO3(浓)==3Cu(NO3)2+2NO↑+4H2O中1molCu消耗8/3molHNO3,故前者多、后者少,正确;C、前者生成红棕色气体,后者生成无色气体,故前者深、后者浅,错误;D、由于铜不足,则转移的电子总数应根据铜计算,由于铜质量相等,故二者应相等,错误。
本题难度:一般
5、填空题 Na2SO3是常用的抗氧剂。
(1)实验室通常用浓硫酸(1:1)和Na2SO3微热制备SO2气体,
反应方程式为:?,制备的SO2气体中通常含有水蒸气,下列干燥剂能干燥SO2气体的是:?;
A.浓硫酸? B.碱石灰? C.无水CaCl2?
(2) 少量SO2气体通入NaOH溶液中可得NaOH和Na2SO3的混合溶液,向该混合溶液中加入少许溴水,振荡后溶液变为无色。碱性溶液中Br2与Na2SO3发生氧化还原反应,反应的离子方程式为______________;
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告;
限选试剂:2 mol·L-1HCl;1 mol·L-1H2SO4;1mol·L-1HNO3;1 mol·L-1BaCl2;
1 mol·L-1Ba(NO3)2;0.1 mol·L-1AgNO3;CCl4;苯;新制饱和溴水;新制饱和氯水。
编号
| 实验操作
| 预期现象和结论
|
步骤①
| 取少量待测液于试管A中,滴加2 mol·L-1HCl至溶液呈酸性,加入几滴________(填试剂),振荡
| ________,证明待测液中含SO32-
|
步骤②
| 另取少量待测液于试管B中,加入?,再滴加适量
1 mol·L-1 BaCl2溶液
| ?
?
|
步骤③
| 另取少量待测液于试管C中,?,振荡,静置后观察颜色
| 溶液分层,上层液体呈橙红色,证明待测液中很Br-
|
?
参考答案:(1) ?2 分? AC? 2分 每个选项1分,错选不给分
?2 分? AC? 2分 每个选项1分,错选不给分
(2)SO32-+Br2+2OH-=H2O+SO42-+2Br-?2分
(3)
编号
实验操作
预期现象和结论
步骤①
新制饱和溴水
溴水褪色
步骤②
加入过量的2 mol·L-1盐酸,
有白色沉淀生成,证明待测液中含SO42-
步骤③
加入足量新制饱和氯水,再加入苯
?
(每空2分)
本题解析:(1)根据强酸制弱酸,浓硫酸(1:1)和Na2SO3微热可制取SO2,化学方程式为: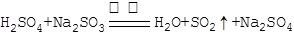 ;SO2为酸性氧化物,不能用碱石灰干燥,可用浓硫酸或无水CaCl2干燥,故A、C项正确。
;SO2为酸性氧化物,不能用碱石灰干燥,可用浓硫酸或无水CaCl2干燥,故A、C项正确。
(2)Br2把Na2SO3氧化为SO42?,在碱性条件下离子方程式为:SO32-+Br2+2OH-=H2O+SO42-+2Br-。
(3)SO32?利用还原性检验,加入新制溴水,SO32?被Br2氧化,现象为溴水褪色;SO42?的检验应先加入足量稀盐酸,排除Ag+、CO32?、SO32?等离子的干扰,然后加入BaCl2溶液,有白色沉淀生成,证明待测液含有SO42?;加入足量新制饱和氯水,可把Br?氧化为Br2,因为上层液体呈橙红色,所以加入了密度小于水的苯。
本题难度:困难