微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
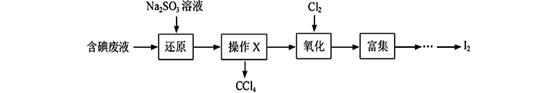
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
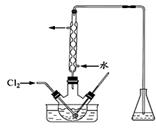
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓 慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
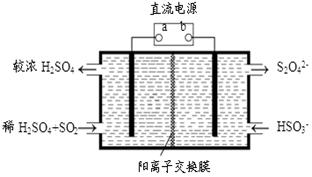
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
参考答案:(15分)
(1)SO32- + I2 + H2O = 2I- + SO42- + 2H+ 使CCl4中的碘进入水层
(2)分液(1分)
(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液
(4)①A为正极,b为负极;阳极电反应式为SO2 + 2H2O
本题解析:
本题难度:一般
2、选择题 用直流电电解下列各溶液一段时间后,溶液的颜色和密度保持不变的是
A.用铜电极电解CuCl2溶液
B.用石墨电极电解Na2SO4溶液
C.用铜电极电解稀H2SO4
D.锌为阳极,铁为阴极,电解ZnCl2溶液
参考答案:AD
本题解析:A.Cu作电极电解CuCl2,阳极:Cu-2e-====Cu2+,阴极:Cu2++2e-====Cu,故CuCl2溶液颜色、密度保持不变;D.锌为阳极,阳极:Zn-2e-====Zn2+,铁为阴极,阴极:Zn2++2e-====Zn,故ZnCl2溶液颜色、密度也不变。
本题难度:简单
3、选择题 用指定的阳极和阴极电解一定组成的P溶液,然后加入一定量物质Q,能使溶液恢复到原来组成的P溶液的正确组合是( )
| 组别 | 阳极 | 阴极 | P溶液 | 物质Q
A
Ag
Cu
AgNO3溶液
AgNO3固体
B
C
Cu
CuSO4溶液
CuO
C
Pt
Pt
NaOH溶液
NaOH固体
D
C
Fe
NaCl溶液
HCl气体
|
A.A
B.B
C.C
D.D
参考答案:A.为电镀装置,溶液浓度不变,加入AgNO3固体,溶液浓度增大,故A错误;
B.电解CuSO4,阴极析出铜,氧气生成氧气,应加入CuO,故B正确;
C.电解NaOH溶液实际上是电解的水,加入一定量的水可恢复原浓度,故C错误;
D.电解食盐水,生成NaOH、H2、Cl2,应通入适量的HCl气体,故D正确.
故选BD.
本题解析:
本题难度:一般
4、选择题 按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。?则下列叙述中正确的是(?)
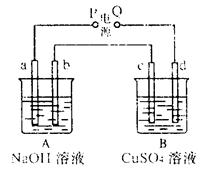
A.电源P极为正极
B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为40H--4e-= 2H2O+O2↑
参考答案:C
本题解析:c极上有Cu析出,所以C电极是阴极,则d电极是阳极,所以Q是正极,P是负极,a是阴极,b是阳极,选项A不正确;惰性电极电解氢氧化钠溶液,相当于电解水,所以电解的水的质量是4.5g,物质的量是0.25mol,生成氢气是0.25mol,氧气是0.125mol。氧气在阳极生成,即b电极生成氧气,气体是2.8L,选项B、D不正确;反应中转移电子是0.5mol,则根据电子的得失守恒可知,析出铜是0.25mol,质量是16g,选项C正确;答案选C。
本题难度:一般
5、填空题 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
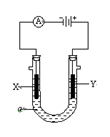
(1)若X是锌、Y是碳棒电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极附近观察到的现象是?。
②Y电极上的电极反应式为? ____________?。
③利用该原理可以制得的化工原料有? ____________ ?。
(2)若要用电解方法精炼粗铜,电解液a选用?溶液,X电极的材料是?。
(3)若要在某铁制小饰品上镀上一层银,则Y电极的材料是?,
X电极反应式是? ___?。
参考答案:(1)①有气体产生,溶液变红(各0.5分,共1分)
② 2Cl一-2e一===Cl2 ↑
③H2、Cl2、NaOH(写出1个给0.5分,写出2个及以上给1分)
(2)铜?纯铜?
(3)Ag?Ag++e-="==" Ag
本题解析:(1)若X是锌、Y是碳棒电极,a是饱和NaCl溶液,该装置为电解食盐水装置,Y为阳极,氯离子在Y极放电,产生了氯气;在X极上产生了氢气和氢氧化钠,所以①由于在两边各滴入几滴酚酞试液,而在X极产生了氢氧化钠,所以在X极附近观察到的现象是为有气体产生,溶液变红;②Y电极上的电极反应式为:2Cl一-2e一===Cl2 ↑;③利用该原理可以制得的化工原料有H2、Cl2、NaOH;(2)若要用电解方法精炼粗铜,电解液a选用铜溶液,X为阴极,故X的材料为纯铜;(3)若要在某铁制小饰品上镀上一层银,则Y电极为阳极,所以Y电极的材料为Ag,X电极的反应式是Ag++e-="==" Ag。
点评:本题考查了电解池,该考点是高考考查的重点和难点,本题难度适中。
本题难度:一般