微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某同学从资料上查到以下反应
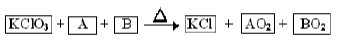
A、B为中学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体。回答下列问题:
(1)元素A、B可形成化合物AB2,则A元素的原子结构示意图为 ,AB2中的化学键是
(2)若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
(3)已知: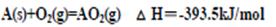

写出AB2(l)在O2中完全燃烧的热化学方程式为
参考答案:(8分)(每空2分)
(1) ,(极性)共价键 (2)1:1(3)AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol
,(极性)共价键 (2)1:1(3)AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol
本题解析:(1)能使澄清石灰水变浑浊的气体可能为CO2、SO2,元素A、B可形成化合物AB2,所以A为C元素、B为S元素,C的原子结构示意图为: ;CS2中化学键是(极性)共价键。
;CS2中化学键是(极性)共价键。
(2)反应中A和B的质量比为3:4,则C、S物质的量之比为2:1,依据原子守恒和化合价的变化,配平可得化学方程式:KClO3+2C+S=2KCl+2CO2+SO2,所以n(KClO3): 91ExaM.orgn(CO2)=1:1。
(3)首先写出AB2(l)在O2中完全燃烧的化学方程式,并注明状态,AB2(l)+3O2 (g)=2BO2(g)+AO2(g),根据盖斯定律,该反应等效于①+2×②-③,可得?H=-1076.8kJ/mol,所以人化学方程式为:AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol。
考点:本题考查物质的推断、原子结构示意图、化学键、热化学方程式的书写。
本题难度:困难
2、填空题 (1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为______.
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,写出该反应的热化学方程式______.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(g)的△H=______.
参考答案:(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,则该燃烧反应的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),
则△H=(-285.8kJ/mol)×2-(-43.992kJ/mol)×2=-483.6kJ/mol,
故答案为:H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol;-483.6kJ/mol.
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
参考答案:(每空2分,共14分)
(1) 1s22s22p63s23p6
(2) Na>Al>S>O
(3)N>O>Al>Na
(4)Na+[: :
: :]2-Na+
:]2-Na+
(5) 第三周期,ⅢA族, Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
(6) ΔH=(2a+b+2c)kJ/mol
本题解析:由A的电子层结构,可以推知为2s22p3,为N,又B和E为同一主族,C、D、E为同周期,B为O或F,C、D、E为第三周期,外层有一个未成对电子的可能为Na和Al,从而确定B为O、E为S。
(1)要注意为S的离子
(2)原子半径先比较电子层,电子层越多半径越大,再比较核电荷数,越多半径越小
(3)第一电离能整体上同周期从左到右为增大趋势,同主族从上到下,减小;这里N为半充满,反常。
(4)Na2O2的电子式
(5)Al的位置以及制备Al(OH)3,要考虑氢氧化铝的两性,既能溶于酸又能溶于碱,故不能用强碱,用氨水。
(6)由盖斯定律有目标反应等于①×2+②+③×2
考点:以物质结构为基础,考查了原子结构、元素周期表和周期律、盖斯定律和热化学方程式的书写。
本题难度:困难
4、选择题 已知化学反应:①C(s)+1/2O2(g) = CO(g) △H1<0
②CO(g) +1/2O2(g) = CO2(g) △H2<0
③C(s)+O2(g) = CO2(g) △H3<0;
相同条件下,下列说法正确的是
A.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
B.反应②反应物的键能之和大于产物键能之和
C.△H1+△H2>△H3
D.△H3 >△H1 ,故CO2比CO稳定