|
|
|
高中化学知识点大全《热化学方程式》高频考点强化练习(2017年最新版)(十)
2017-08-01 00:03:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 2013年,央视《经济半小时》曝光了部分药企用工业硫磺熏制山银花以及没有功效的山银花杂质入药,其中包括广药集团旗下药厂生产的维C银翘片.维C银翘片被曝光“涉硫”后,给中药制药企业敲响了警钟.在恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g)?2SO3(g),△H=-196.6KJ/mol)

请回答下列问题:
(1)写出能表示固体硫的燃烧热的热化学方程式:______.
(2)恒温恒容时,lmol SO2和2mol O2充分反应,放出热量的数值比|△H2|______(填“大”、“小”或“相等”)
(3)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为______.
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的百分含量最高的一段时间是______.
(5)各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t3-t4 | t5-t6 | t6-t7
K1
K2
K3
K4
|
K1、K2、K3、K4之间的关系为______.
参考答案:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O.
故答案为:2mol;2SO2+O2+4OH-═2SO42-+2H2O;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动;t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,所以t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
故答案为:升高温度;t3~t4;
(5)由(4)的分析可知t2~t3段为增大压强,则K2=K1;t4~t5段为升高温度,则K3<K2;所以K4=K3<K2=K1;
故答案为:K4=K3<K2=K1.
本题解析:
本题难度:简单
2、填空题 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1
B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1
C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1
D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1
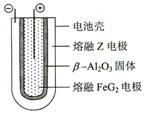
| (5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
参考答案:(16分)(1)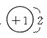 (2分) 第二周期IVA族(2分) (2)HClO4(1分H2S(1分) (2分) 第二周期IVA族(2分) (2)HClO4(1分H2S(1分)
(3)H2SiO3(1分),HCl(1分),H2和O2混合发生爆炸或生成的Si部分被O2氧化成SiO2(1分)
(4)C (3分) (5)Fe2+ +2e- =" Fe" (2分), β-Al2O3 (2分)
本题解析:上述六种元素都是短周期元素,所以根据已知性质推:Q单质为淡黄色固体,则Q是S,在S之后的短周期主族元素是Cl,即G为Cl,用于同位素测定的为C,Y为C元素,与C同主族的M应该是Si,在C元素之前的X元素与同主族元素Z形成离子化合物ZX,则X、Z均在第一主族,且分别为H、Na,所以综上可得X、Y、Z、M、Q、G元素分别是H、C、Na、Si、S、Cl。
(1)X是H元素,所以在NaH中,H-的离子结构示意图为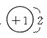 ,Y为C元素,其位置是:第二周期,第IVA族。 ,Y为C元素,其位置是:第二周期,第IVA族。
(2)在这6种元素中非金属最强的是Cl,其最高价氧化对应的水化物HClO4酸性最强;Q、G的氢化物分别为H2S、HCl,因为非金属性Cl>S,单质的氧化性Cl2>S,所以离子的还原性Cl-<S2- ,所以还原性强的氢化物是H2S。
(3)MXG3与X2 分别为SiHCl3和H2,所以利用二者制备高纯硅时,若混入了水SiHCl3会与H2O发生剧烈水解反应,生成硅酸H2、H2SiO3和HCl;如果混入了氧气,则高温加热不纯H2会发生爆炸,或者O2又会氧化高温生成的单质硅,所以要控制无水无氧环境。
(4)X2Q是H2S,H2S燃烧是一个放热反应,所以△H<0,燃烧热a kJ·mol-1是指1mol该物质完全燃烧生成稳定氧化物SO2时所释放的能量,所以如果方程式系数是2时,对应的焓变△H=" -2a" kJ·mol-1 ,所以应该选择C。
(5)该电池反应式为:2Na+FeCl2 Fe+2NaCl,所以可知该反应中放电时单质Na作电池负极失去电子被氧化,Fe2+作正极得到电子被还原为Fe单质,所以正极反应式为:Fe2+ + 2e- =Fe;由于电池反应式在熔融状态下进行的,所以从图像可以判断出该电池的电解质溶液是β-Al2O3。 Fe+2NaCl,所以可知该反应中放电时单质Na作电池负极失去电子被氧化,Fe2+作正极得到电子被还原为Fe单质,所以正极反应式为:Fe2+ + 2e- =Fe;由于电池反应式在熔融状态下进行的,所以从图像可以判断出该电池的电解质溶液是β-Al2O3。
考点:本题考查的是元素周期表和元素周期律、非金属及其化合物性质、化学反应与能量、电化学基础等知识。
本题难度:困难
3、选择题 已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
|
参考答案:C
本题解析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g) △H2,③2CO(g)+O2(g)=2CO2(g) △H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s) △H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3=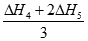 ,D错误,答案选C.
,D错误,答案选C.
考点:盖斯定律
本题难度:一般
4、填空题 (6分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;事实上,反应的热量总小于理论值,为什么?
参考答案:放出(2分),46.2(2分);该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值。(2分)
本题解析:考查反应热的计算、化学反应能量变化的原因以及可逆反应的特点。在化学反应中断键是吸热的,形成化学键是放热的,如果断键吸收的能量高于形成化学键所放出的能量,则就是吸热反应,反之是放热反应。根据键能可知断键吸收的能量是436kJ×3+946 kJ=2254 kJ,形成化学键放出的能量是2×3×391 kJ=2346 kJ,所以是放热反应,即每生成2mol氨气放热是2346 kJ-2254 kJ=92 kJ,因此每生成1mol NH3放出46.kJ热量。因为氨气的合成是可逆反应,3魔力氢气和1mol氮气不可能生成2mol氨气,所以反应的热量总小于理论值。
本题难度:一般
5、填空题 (18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
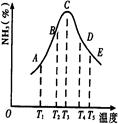
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强
E.加入催化剂 F.吸收NH3 G.通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
参考答案:(1) AB (2) (3)BCFG
(4) AC段,反应开始时温度升高,反应速率增大,反应向正反应方向进行,生成NH3;CE段,已经达到平衡,升高温度使平衡向逆反应方向移动NH3%变小
本题解析:(1)N2、H2合成NH3反应是放热的,升高温度平衡逆向移动,NH3的百分含量降低,所以升高温度NH3的百分含量升高,说明反应未答平衡。因此AB两点是未达到平衡的点。
(2) N2 + 3H2 = 2NH3
起始 1mol 3mol 0
反应 xmol 3xmol 2xmol
T3时 (1-x)mol (3-3x)mol 2xmol
根据T3时体系压强为原来的7/8,则有 ,所以x=0.25mol。
,所以x=0.25mol。
所以生成0.5molNH3放热23.1 kJ,则热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol。
(3)根据N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol可知,增大压强,降低温度,吸收氨气,通入氮气,都可以增加氨气的产率。
(4)从AC段可以看出平衡正向移动,说明反应没有达到平衡,所以升高温度扔正向移动,CE段可以看出平衡逆向移动,说明反应达到平衡,升高温度平衡逆向移动。
考点:化学平衡与化学反应热
点评:本题综合性强,主要考查学生分析问题的能力,是高考的热点习题。
本题难度:困难
 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
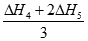 ,D错误,答案选C.
,D错误,答案选C. 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
 ,所以x=0.25mol。
,所以x=0.25mol。