微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: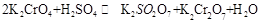
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)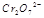 在水溶液中为红色,
在水溶液中为红色,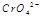 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
 ;
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?

Ⅱ.固定和利用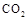 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用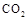 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
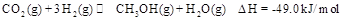
某科学实验将6mol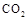 和8molH
和8molH 充入一容积为2L的密闭容器中,测得H
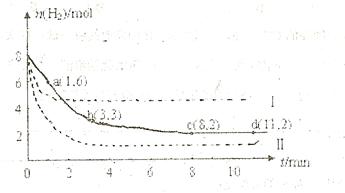
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(
的物质的量随时间变化如右图中实线所示( 图中字母后数字表示对应的坐标):
图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气 体的密度不再改变
体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
参考答案:

本题解析:略
本题难度:困难
2、填空题 (3分)下表列出了几种键的键能:
化学键
| H—H
| Cl—Cl
| H—Cl
|
键能/kJ·mol-1
| 436
| 243
| 431
|
请根据以上信息写出氢气在氯气燃烧生成氯化氢气体的热化学方程式:
。
参考答案:H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ/mol
本题解析:根据方程式:H2(g)+Cl2(g)=2HCl(g);ΔH =E(反应物)-E(生成物)=436+243-2×431=-183 kJ/mol
考点:考查热化学方程式的计算与书写。
点评:根据键能计算反应热:ΔH =E(反应物)-E(生成物),属于简单题。
本题难度:一般
3、填空题 (1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为______.
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,写出该反应的热化学方程式______.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(g)的△H=______.
参考答案:(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,则该燃烧反应的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),
则△H=(-285.8kJ/mol)×2-(-43.992kJ/mol)×2=-483.6kJ/mol,
故答案为:H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol;-483.6kJ/mol.
本题解析:
本题难度:一般
4、填空题 (12分)氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式 。

(2)已知:H-H、N≡N键能分别为435kJ·mol-1、943kJ·mol-1,则结合(1)图中数据,计算N-H的键能 kJ·mol-1。
(3)已知:N2(g)+2O2(g) N2O4(l);△H1=" -19.5" kJ·mol-1;
N2H4(l)+O2(g) N2(g)+2H2O(g) ;△H2=" -534.2" kJ·mol-1
肼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。写出该反应的热化学方程式 。
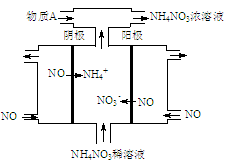
(4)工业上可电解NO制备NH4NO3,其工作原理如图所示,该阳极发生的电极反应式为 。为使电解产物全部转化为5mol NH4NO3,需补充的物质是 (填化学式),此时电子转移的物质的量为 mol。
参考答案:(1)N2(g) + 3H2(g) 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
(2)390 (3)2N2H4(l)+N2O4(l)= 3N2(g) + 4H2O(g) △H= -1048.9 kJ/mol
(4)NO-3e-+2H2O=NO3-+4H+ 氨气 15
本题解析:(1)根据图示,反应热为E1-E2=254-300=92kJ/mol,所以热化学方程式写成:N2(g) + 3H2(g) 2NH3(g) △H= -92kJ/mol(2)根据反应热=反应物的键能总和-生成物的键能总和计算,-92=943+3×435-6x, x=390kJ·mol-1。(3)将方程式标记为①和②,根据盖斯定律,②×2-①,计算反应热=-534.2×2+19.5=-1048.9 kJ/mol。(4)阳极反应是一氧化氮失去电子变成了硝酸根离子,即为NO-3e-+2H2O=NO3-+4H+,总反应为8 NO+2NH3+7H2O=5NH4NO3,所以为使电解产物全部转化为5mol NH4NO3,需补充的物质是氨气,此时电子转移的物质的量为15mol。
2NH3(g) △H= -92kJ/mol(2)根据反应热=反应物的键能总和-生成物的键能总和计算,-92=943+3×435-6x, x=390kJ·mol-1。(3)将方程式标记为①和②,根据盖斯定律,②×2-①,计算反应热=-534.2×2+19.5=-1048.9 kJ/mol。(4)阳极反应是一氧化氮失去电子变成了硝酸根离子,即为NO-3e-+2H2O=NO3-+4H+,总反应为8 NO+2NH3+7H2O=5NH4NO3,所以为使电解产物全部转化为5mol NH4NO3,需补充的物质是氨气,此时电子转移的物质的量为15mol。
考点:热化学方程式的书写,电解原理的应用。
本题难度:一般
5、填空题 按要求作答:
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):______,实验室配制FeCl3溶液的方法是______.
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂.写出使用时发生反应的离子方程式:______.
(3)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ?mol-1;N2H4(g)+O2(g)═N2(g)+2H2O?(g),△H=-534KJ?mol-1
则N2H4和NO2反应的热化学方程式为______.
(4)常温下,设pH?均为6的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1、c2,则
=______.
(5)常温下,pH=13的Ba(OH)2溶液aL与PH=1的H2SO4溶液bL混合(混合后溶液体积变化忽略不计).若所得混合溶液PH=12,则a:b=______.
参考答案:(1)Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊;
(1)Al2(SO4)3溶液水解成酸性,NaHCO3溶液水解成碱性,二者发生互促水解生成Al(OH)3和CO2,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ?mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ?mol-1
依据盖斯定律,②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135,7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135,7KJ/mol;
(4)常温下,水溶液中存在离子积常数,[H+]?[OH-]=10-14;pH 均为6的H2SO4和溶液中由水电离出的氢离子浓度C1=10-8mol/L;A12(SO4)3溶液中,铝离子水解生成氢氧化铝和盐酸,由水电离出的C2=10-6mol/L;则C1C2=10-810-6=1100;
故答案为:1:100;
(5)常温下,pH=13的Ba(OH)2溶液aL,溶液中氢氧根离子物质的量=10-1mol/L×aL=0.1amol;PH=1的H2SO4溶液bL中含氢离子物质的量=0.1mol/L×bL=0.1bmol;混合后溶液体积变化忽略不计,溶液体积为(a+b)L;混合溶液中氢氧根离子浓度=10-2mol/L;所以得到0.1a-0.1ba+bmol/L=10-2mol/L;计算得到a:b=11:9,
故答案为:11:9.
本题解析:
本题难度:一般