微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:H2O(g)===H2O(l) ?ΔH=—Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ?ΔH=—Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)?ΔH=—Q3 kJ·mol-1
若使46 g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ
B.(Q2—3Q1—Q3) kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ
D.(3Q1-Q2+Q3) kJ
参考答案:D
本题解析:根据盖斯定律可知,将①H2O(g)===H2O(l)、②C2H5OH(g)===C2H5OH(l)和③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)叠加,即①×3+③-②得到C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l),所以△H=-(3Q1-Q2+Q3) kJ /mol,46g液态酒精是1mol,所以答案是D。
本题难度:简单
2、选择题 一种“即食即热型”快餐适合外出旅行时使用.它是利用两种物质发生化学反应对食物进行加热,这两种化学物质最适合的选择是
A.浓硫酸与水
B.生石灰与水
C.熟石灰与水
D.氯化钠与水
参考答案:B
本题解析:A错,浓硫酸与水溶解放热,但浓硫酸具有强烈的腐蚀性,且稀释反的稀硫酸也会污染环境;B正确,生石灰与水反应放出大量热量,且无腐蚀性价格也便宜;C错,熟石灰与水反应热量变化不明显;D错,氯化钠溶于水热量变化也不明显;
本题难度:一般
3、选择题 工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g)? ΔH=+131.4 kJ/mol,下列判断正确的是(?)
A.反应物能量总和小于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
参考答案:AC
本题解析:A.该反应是吸热反应说明生成物的总能量大于反应物的总能量。正确。B.CO(g)+H2(g)=C(s)+H2O(g)? ΔH=-131.4 kJ/mol。错误。C.根据反应的热化学方程式可知:在水煤气反应中,每生成1 mol H2(g)和CO(g)就会吸收131.4 kJ热量。正确。D.在热化学方程式中,计量数只表示该物质的物质的量。错误。
本题难度:一般
4、填空题 同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)====P4O10(s)
ΔH="-2" 983.2 kJ·mol-1①
P(s,红磷)+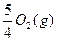 ====
====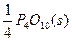 ?
?
ΔH="-738.5" kJ·mol-1②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。
参考答案:P4(s,白磷)====4P(s,红磷)
ΔH="-29.2" kJ·mol-1?红磷?低
本题解析:①-4×②得P4(s,白磷)=4P(s,红磷)? ΔH=ΔH1-4ΔH2="-2" 983.2 kJ·mol-1-4×(-738.5 kJ·mol-1)="-29.2" kJ·mol-1,即P4(s,白磷)====4P(s,红磷)? ΔH="-29.2" kJ·mol-1。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。
本题难度:简单
5、简答题 关于化学反应与能量的说法中正确的是( )
A.化学反应的反应热与反应的路径有关
B.反应热包括燃烧热、中和热、溶解热等
C.凡经过加热而发生的化学反应都是吸热反应
D.酸碱中和反应属于吸热反应
参考答案:A、根据盖斯定律,反应热的大小只和反应的始态、终态有关,和反应的途径无关,故A错误;
B、根据反应情况的不同,反应热有多种,常见的有燃烧热、中和热、熔解热等,故B正确;
C、反应条件和反应是吸热还是放热无关,和化学键的断裂和形成有关,故C错误;
D、酸碱中和反应属于放热反应,故D错误.
故选B.
本题解析:
本题难度:一般