微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 炽热的炉膛内有反应:C(s)+O2(g)=CO2(g),△H=-392kJ·mol—1 往炉膛内通入水蒸汽时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g),△H=+131 kJ·mol—1? CO(g) + 1/2O2(g)= CO2(g),ΔH="-282" kJ·mol—1 H2(g)+1/2O2(g)=H2O(g),△H=-241kJ·mol—1,由以上反应推断往炽热的炉膛内通入水蒸汽时( )
A.既能使炉火更旺,又能节省燃料
B.虽不能使炉火更旺,但可以节省燃料
C.不能节省燃料,但能使炉火瞬间更旺
D.既不能使炉火更旺,又不能节省燃料
参考答案:C
本题解析:由于高温下碳和水蒸气反应生成氢气和CO,所以燃烧会更旺。但根据能量守恒定律可知,不能节省燃料,答案选C。
本题难度:一般
2、选择题 已知反应A2+B2===2AB,破坏1 mol A2中的化学键消耗的能量为Q1 kJ,破坏1 mol B2中的化学键消耗的能量为Q2 kJ,形成1 mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
A.若该反应为吸热反应,则Q1+Q2<2Q3
B.若该反应为放热反应,则Q1+Q2>Q3
C.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热
D.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热
参考答案:D
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,据此可知,若该反应为吸热反应,则Q1+Q2>2Q3。若该反应为放热反应,则Q1+Q2<2Q3,选项AB都是错误的。若A2和B2的总能量之和大于生成的AB的总能量,则反应放热,反之是吸热反应,因此选项D正确,C不正确,答案选D。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对影响反应热大小的熟悉了解程度,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:简单
3、选择题 已知:① S(单斜,s)+O2(g) = SO2(g)? △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) = SO2(g)? △H2=-296.83 kJ·mol-1
③ S(单斜,s) =? S(正交,s)? △H3
下列说法正确的是(?)
A.S(单斜)和S(正交)互为同分异构体
B.△H3= + 0.33 kJ·mol-1 ,单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s) = S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s) = S(正交,s) △H3>0,单斜硫比正交硫稳定
参考答案:C
本题解析:S(单斜)和S(正交)互为同素异形体,A不正确;根据盖斯定律可知①-②即得到S(单斜,s) =S(正交,s),所以该反应的反应热△H3=-297.16 kJ/mol+296.83 kJ/mol=-0.33kJ/mol,即该反应是放热反应,所以单斜硫比正交硫的能量高。能量越低越稳定,则正交硫比单斜硫稳定,C正确,BD错误,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,主要是考查学生灵活运用基础知识解决实际问题的能力,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
4、选择题 下列依据热化学方程式得出的结论正确的是 (?)? ( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1, 则氢气的燃烧热为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
参考答案:D
本题解析:A、燃烧热是指1mol物质完全燃烧生成最稳定的化合物所放出的热量;氢气的燃烧热必须是1mol氢气燃烧生成液态水的过程所放出的热量,错误;B、已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,醋酸为弱电解质,反应过程中不断电离,醋酸的电离吸热,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ,错误;C、碳完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,错误;D、已知C(s,石墨)═C(s,金刚石)△H>0,石墨能量小于金刚石,则石墨比金刚石稳定,正确。
本题难度:一般
5、选择题 已知:①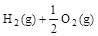 =H2O(g) △H1=a kJ
=H2O(g) △H1=a kJ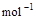 , ②
, ② =2H2O(g)△H2=b kJ
=2H2O(g)△H2=b kJ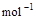 ,
,
③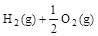 =H2O(l) △H3=c kJ
=H2O(l) △H3=c kJ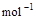 , ④
, ④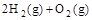 =2H2O(l)
=2H2O(l)
△H4=d kJ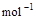 。下列关系式中正确的是(?)
。下列关系式中正确的是(?)
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
正确答案:C
将①×2就可得到②,所以△H2=2△H1,即2a=b,两者均是放热反应,故2a=b<0,C正确;
A、不正确,c<a<0,③生成液态水,放热多,△H更小;B、b和d均小于0;D、c和d均小于0,D不正确。
本题难度:一般