微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲试管中盛有0.5mol/L?Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L?Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为
A.甲=乙
B.甲>乙
C.甲<乙
D.无法确定
参考答案:C
本题解析:由于碳酸钠和盐酸的反应是分步进行的,即方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据方程式可知,乙中生成的CO2多,答案选C。
本题难度:困难
2、选择题 将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水(氯水具有氧化性,能将Fe2+化为Fe3+)呈红色的是
A.FeO
B.Fe2O3
C.FeCl3
D.Fe2(SO4)3
参考答案:A
本题解析:B、C、D三种物质溶于酸后,溶液中均含Fe3+,滴加KSCN溶液后均呈红色.FeO溶于盐酸后得到FeCl2溶液,滴加硫氰化钾溶液没有颜色变化,再加入氯水后生成Fe3+,溶液呈红色.
本题难度:困难
3、选择题 下列盐溶液中,加入BaCl2溶液生成白色沉淀,再加入稀HNO3振荡,白色沉淀不消失的是
A.Na2SO3
B.K2CO3
C.Na3PO4
D.Na2SiO3
参考答案:AD
本题解析:Na2SO3+BaCl2![]() BaSO3↓+2NaCl,BaSO3被HNO3氧化为BaSO4,Na2SiO3+BaCl2
BaSO3↓+2NaCl,BaSO3被HNO3氧化为BaSO4,Na2SiO3+BaCl2![]() BaSiO3+2NaCl,BaSiO3+2HNO3
BaSiO3+2NaCl,BaSiO3+2HNO3![]() Ba(NO3)2+H2SiO3↓。
Ba(NO3)2+H2SiO3↓。
本题难度:一般
4、选择题 a?g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a?g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.7:1
B.1:7
C.7:8
D.8:7
参考答案:A
本题解析:分析:Fe先与CuSO4反应,再与H2SO4反应,根据反应的顺序和相关的量进行计算.
解答:ag铁粉为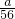 mol,agCu为
mol,agCu为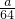 mol,根据氧化还原顺序Fe先与CuSO4反应,再与H2SO4反应,因为
mol,根据氧化还原顺序Fe先与CuSO4反应,再与H2SO4反应,因为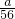 mol>
mol>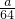 mol,
mol,
所以CuSO4反应完全,剩余Fe与H2SO4反应,
所以参加反应的CuSO4的物质的量为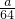 mol,
mol,
参加反应的H2SO4的物质的量为(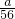 -
-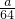 )mol,
)mol,
参加反应的CuSO4和H2SO4的物质的量之比为: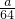 :(
:(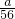 -
-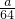 )=7:1,
)=7:1,
故选A.
点评:本题考查学生对金属铁的性质的掌握,可以根据所学知识进行回答,难度较大.
本题难度:困难
5、选择题 在硫酸铁溶液中,加入a?g?铜,完全溶解后,又加入b?g铁,充分反应后得到c?g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中不含有Cu2+
B.残余固体一定全部是铜
C.最后得到的溶液中只含Cu2+
D.残余固体可能为铁、铜混合物
参考答案:D
本题解析:由于b小于c,所以最终所得的固体一定含有铜,但也可能含有铁,因此选项D正确,其余都是错误的,答案选D。
本题难度:困难