| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》在线测试(2017年最新版)(十)
参考答案:C 本题解析: 本题难度:一般 2、选择题 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg |
参考答案:AC
本题解析:A、根据图像可知A点AG=0,则c(H+) = c(OH-),即溶液显中性。由于醋酸钠水解显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,A错误;B、开始是AG=6,则根据AG=lg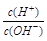 并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。
并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。
考点:考查酸碱中和滴定图像分析以及离子浓度大小比较
本题难度:一般
3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(H+)= c(OH—)
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:A、根据电荷守恒可知c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),A不正确;B、强碱弱酸盐水解溶液应呈碱性c(H+)<c(OH—),B不正确;C、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S),C不正确;
D、根据质子守恒可知c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确。
考点:了解盐类水解的原理、盐溶液酸碱性、影响盐类水解程度的主要因素、盐类水解的应用。
点评:主要考查对盐类水解判断溶液酸碱性、电解质溶液中三“守恒”等考点的理解。电荷守恒式注意关注离子电荷数,物料守恒重点是弄清所考查原子的个数比,质子守恒应重点分析H+与失去H+所得到的离子的去向。
本题难度:一般
4、选择题 室温时将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若pH>7,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c1<c2
D.若V1=V2、c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:A
本题解析:A.c1V1=c2V2时,NaOH溶液和CH3COOH溶液恰好完全反应,生成的CH3COONa为强碱弱酸盐,水解呈碱性,c1V1>c2V2时,NaOH溶液过量也使溶液呈碱性,错误;B.无论二者恰好完全反应还是其中一种物质过量,溶液中只有Na+、H+、CH3COO-、OH-四种离子,由电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),正确;C.NaOH溶液和CH3COOH溶液恰好完全反应时溶液呈碱性,只有CH3COOH溶液稍过量中和溶液的碱性才能使pH=7,若V1=V2,则一定是c2>c1,正确;D.若V1=V2,c2=c1,则二者恰好完全反应,由物料守恒可知c(CH3COO-)+c(CH3COOH) =c(Na+),正确。
考点:考查弱电解质在水溶液中的电离平衡、盐类水解的原理、水的电离。
本题难度:一般
5、填空题 常温下,用0.1000 mol·L-l NaOH溶液滴定20. 00mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。 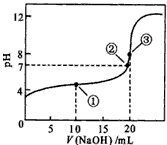
(1)反应过程中,存在电离平衡的物质的化学式为________________;
(2)在加入20. 00 mL NaOH溶液时,pH显示大于7,用离子方程式表示其原因:__________________;
(3)点①所示溶液中,各离子浓度从达到小的顺序为_____________________;
(4)点②所示溶液中,不同离子的浓度存在多种等量关系,写出其中的2种:_________、_________。
参考答案:(1)CH3COOH、H2O
(2)CH3COO-+H2O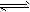 CH3COOH+OH-
CH3COOH+OH-
(3)c( CH3COO-) >c( Na+) > c(H+)> c(OH-)
(4)c( OH-) = c(H+)、c(CH3COO-)+c(OH-)=c(Na+) +c(H+)、c(CH3COO-) =c(Na+) (任意两个即可)
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《常见无机物.. | |