微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,向1 mL pH=1的硫酸中滴加的10 mL pH= b的NaOH溶液,形成的混合溶液成碱性则b可能为?(?)
A.10
B.11
C.12
D.13
参考答案:D
本题解析:混合后溶液显碱性,说明氢氧化钠是过量的,即0.001L×0.1mol/L<0.01L×10(b-14),解得b>12,所以只有选项D是正确的。
本题难度:简单
2、选择题 常温下,将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是(?)
A.b>a=d>c
B.a=b>c>d
C.a=b>d>c
D.c>a=d>b
参考答案:A
本题解析:pH=3的盐酸中c(H+)=1×10-3 mol·L-1,与c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液混合,混合液呈中性时二者的体积相等;NH3·H2O为弱电解质,1×10-3 mol·L-1的氨水中c(OH-)<1×10-3 mol·L-1,因此1×10-3 mol·L-1的氨水和c(OH-)=1×10-3 mol·L-1的氨水分别与盐酸混合,混合液呈中性时,b>c。
本题难度:一般
3、填空题 按要求填空:
(1)原子种类由 决定;第三周期半径最小的元素形成的简单离子的离子结构示意图是 ;
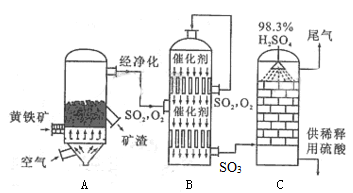
(2)以黄铁矿为原料生产硫酸的工艺流程如下左图所示,设备B的名称为 ;设备A中发生反应的化学方程式 ;
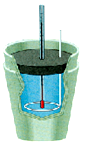
(3)如下右图是实验室中常用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫 ;
(4)0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出表示CH3OH(l)燃烧热的热化学方程式 。
参考答案:(1)质子数和中子数或质子数和质量数 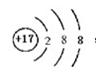
(2)接触室 
(3) 简易量热计 & #160; 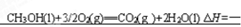
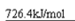
本题解析:原子种类由质子数和中子数或质子数和质量数,同周期中,原子半径随原子序数的增大而减小,因此第三周期半径最小的元素是氯元素,所以它的离子结构示意图是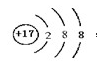 。设备B的名称为接触室。以黄铁矿为原料生产硫酸的工艺流程中,在接触室主要发生了
。设备B的名称为接触室。以黄铁矿为原料生产硫酸的工艺流程中,在接触室主要发生了 。测定盐酸和氢氧化钠溶液反应热主要的仪器是简易量热计。书写燃烧热时需注意要标出各物质的状态,以及燃耗热是指燃耗一摩尔燃料,生物稳定的物质所释放出来的热量,因此甲醇的燃烧热化学方程式为
。测定盐酸和氢氧化钠溶液反应热主要的仪器是简易量热计。书写燃烧热时需注意要标出各物质的状态,以及燃耗热是指燃耗一摩尔燃料,生物稳定的物质所释放出来的热量,因此甲醇的燃烧热化学方程式为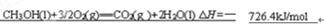
考点:考查原子种类决定因素以及工业制备硫酸及燃烧热的相关知识
本题难度:一般
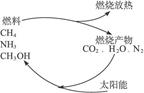
4、选择题 有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,使之能够实现循环利用,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环图中太阳能最后转化为(?)
A.化学能
B.热能
C.生物能
D.电能
参考答案:B
本题解析:关键信息是利用太阳能使CO2、H2O、N2重新组合,根据图示可知组合成可燃物,而可燃物燃烧时转化为产物并放出热量,产物又结合太阳能转化为燃料,如此循环,可知太阳能最终转化为热能。
本题难度:简单
5、选择题 室温时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
参考答案:B
本题解析:根据溶液的PH分别计算溶液中c(H+)和c(OH-),酸碱溶液混合pH=7,则说明n(H+)=n(OH-),以此进行计算,强酸溶液pH=a,则c(H+)=10-amol/L,强碱溶液pH=b,则c(OH-)=10b-14mol/L,酸碱溶液混合pH=7,则说明n(H+)=n(OH-),则有:V(酸)×10-amol/L=V(碱)×10b-14mol/L,答:碱溶液体积V(碱)和酸溶液体积V(酸)的关系为V(碱)=102V(酸)
点评:考查酸碱混合的计算,题目难度中等,注意从酸碱溶液混合pH=7,n(H+)=n(OH-)的角度解答。
本题难度:简单