微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 使反应4NH3(g)+3O2(g)===2N2(g)+6H2O在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。此反应的平均速率v(X)为( )
A.v(NH3)=0.02 mol·L-1·s-1
B.v(O2)=0.01 mol·L-1·s-1
C.v(N2)=0.02 mol·L-1·s-1
D.v(H2O)=0.02 mol·L-1·s-1
参考答案:A
本题解析:半分钟后N2的物质的量增加了0.6 mol,v(N2)=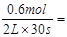 0.01mol·L-1·s-1。根据速率之比等于计量系数之比,可求得v(NH3)=0.02 mol·L-1·s-1,v(O2)=0.015 mol·L-1·s-1,v(H2O)=0.03 mol·L-1·s-1。答案选A。
0.01mol·L-1·s-1。根据速率之比等于计量系数之比,可求得v(NH3)=0.02 mol·L-1·s-1,v(O2)=0.015 mol·L-1·s-1,v(H2O)=0.03 mol·L-1·s-1。答案选A。
点评:本题属于最基本的化学反应速率计算习题,较容易。
本题难度:一般
2、选择题 2008年,中国人民经受了雪灾、震灾等自然灾害的严峻考验,漫长的灾后重建需要大量的钢铁.高炉炼铁中发生的基本反应为Fe2O3+3CO

2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是( )
A.升高温度
B.建容量大的高炉,增大铁矿石的投入量
C.增大CO的浓度
D.将铁矿石粉碎,尽可能用小块的铁矿石
参考答案:根据题意知,该题是判断化学反应速率的影响因素是否正确.
A、升高温度,无论是放热反应还是吸热反应,化学反应速率都增大,故A正确.
B、固体铁矿石的多少不影响反应速率,也不影响平衡移动,故B错误.
C、增大反应物的浓度,化学反应速率增大,故C正确.
D、铁矿石粉碎,尽可能用小块的铁矿石,增大反应物的接触面积,化学反应速率增大,故D正确.
故选B
本题解析:
本题难度:简单
3、实验题 (9分)在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入lOOmL、O.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌表面产生的气泡没有投人到稀盐酸中的快。大家分析、讨论后认为产生这一现象的原因可能有两个:氯离子对反应起了正的催化作用,即氯离子加快了反应;
另一种可能是硫酸根离子对反应起了负催化作用,即硫酸根离子阻碍了反应的进行。持前一种观点的三位同学设计实验并根据实验现象认为均证实了自己的推论是正确的,他们的实验方案和实验现象分别是:
甲:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmL0.1mol/L的稀硫酸中,并加入适量氯化钠固体,发现反应速率加快;
乙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入lOOmLO.1mol/L的稀硫酸中,并加入适量氯化锌固体,发现反应速率加快;
丙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmLO.1moL/L的稀硫酸中,并加入适量氯化钡固体,发现反应速率加快;
请你对三位同学的实验方案作出评价,他们能否得出“氯离子对反应起了正的催化作用”的结论,并简要说出弹由.
甲:________;____________________________________________________________
乙:________;____________________________________________________________
丙:________;____________________________________________________________
参考答案:(9分,结论1分,理由2分)
甲:不能,因为可能是钠离子起了正催化作用;
乙:能,因为反应中均有锌离子生成,因此可以排除锌离子干扰,反应速率加快只能是氯离子起了正催化作用;
丙:不能,因为适量钡离子沉淀了硫酸根,反应速率加快也可能是因为排除了硫酸根离子的阻碍作用。
本题解析:①由于甲加入的是氯化钠,从而引入了钠离子,而钠离子也可能起了正催化作用,所以甲同学的结论是错误的。
②乙同学的结论是正确的,因为反应中均有锌离子生成,因此可以排除锌离子干扰,反应速率加快只能是氯离子起了正催化作用。
③在丙中由于生成硫酸钡沉淀,因此反应速率加快也可能是因为排除了硫酸根离子的阻碍作用而导致的。
本题难度:一般
4、计算题 某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
试求:(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率
参考答案:(1)K = 5×10-3mol-2·L2
(2)C0(H2) =" 17.5" mol·L-1
(3)v(N2) =" 1.25" mol·L-1·min-1
(4)α(N2) = 33.3%
本题解析:由“三段式”求解
反应:?N2(g)?+?3H2(g)  ?2NH3(g)
?2NH3(g)
初c:?7.5? 17.5? 0
△c:?2.5? 7.5? 5
平衡c:? 5? 10? 5
(1)K=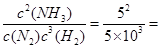 5×10-3mol-2·L2
5×10-3mol-2·L2
(2)C0(H2) =" 17.5" mol·L-1
(3)v(N2) = ="1.25" mol·L-1·min-1
="1.25" mol·L-1·min-1
(4)α(N2) =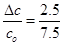 = 33.3%
= 33.3%
本题难度:简单
5、选择题 在一定条件下,CO(g)和H2(g)发生反应:CO(g) + 2H2(g) 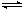 CH3OH(g)?△H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
CH3OH(g)?△H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
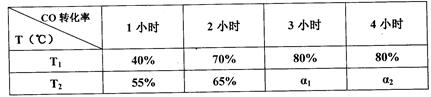
下列说法中正确的是
A.热化学方程式中a>0
B.T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L.h)
C.T1℃下,该反应的化学平衡常数为25
D.T2℃下,ɑ1=ɑ2﹥80%
参考答案:C
本题解析:A、分析题给数据知,第一小时内T2℃时反应速率快,温度T1<T2,结合转化率分析,该反应为放热反应,热化学方程式中a<0,错误;B、根据题给数据分析,T1℃下,在第一小时内CO的物质的量浓度浓度变化为0.4mol/L,结合反应方程式知,H2的浓度变化为0.8mol/L,用H2表示的化学反应速率为0.8mol/(L.h),错误;C、根据题给数据分析,T1℃下,该反应达平衡时各物质的平衡浓度为:CO0.2mol/L,H20.4mol/L,CH3OH0.8mol/L,代入平衡常数表达式计算得化学平衡常数为25,正确;D、分析题给数据知,第一小时内T2℃时反应速率快,先达到平衡,温度T1<T2,结合转化率分析,该反应为放热反应,升温平衡向吸热反应方向移动,T2℃下,ɑ1=ɑ2<80%,错误。
本题难度:简单