微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是
A.A元素的单质可以把B元素的单质从NaB溶液中置换出来
B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高
C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol
HB分子中H-B键断裂时吸收的能量多
D.常温下,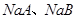 溶液的pH均大于7
溶液的pH均大于7
参考答案:B
本题解析:A、A、B是短周期VIIA族的两种元素,A的非金属性比B强,则A为F元素,B为Cl元素,F2与NaCl溶液反应,实际反应为F2与H2O反应生成O2,错误;B、短周期VIIA族为活泼非金属,与Na元素结合的化合物为离子化合物,F?半径小于Cl?半径,则NaF的晶格能大于NaCl的晶格能,所以NaF晶体的熔点比NaCl高,正确;C、HF的沸点比HCl的沸点高,是因为HF分子间形成了氢键,作用力大于HCl分子间的范德华力,错误;D、因为NaCl为强酸强碱盐,所以常温下,NaCl溶液的pH等于7,错误。
本题难度:一般
2、选择题 下列变化过程中,只破坏共价键的是
[? ]
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列化学用语正确的是?
[? ]
A.S2-的原子结构示意图为?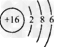
B.碳—12可表示为12C ?
C.—OH的电子式为? ?
?
D.NaCl的分子式为NaCl
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列各对原子形成化学键中共价键成分最少的是
[? ]
A.Li,F
B.Na,F
C.Na,Cl
D.Mg,O
参考答案:B
本题解析:
本题难度:简单
5、填空题 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题
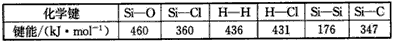
(1)比较下列两组物质的熔点高低(填“>”或“<”) SiC____Si;SiCl4____SiO2。
(2)能不能根据键能的数据判断单质Si和化合物SiCl4的熔点高低?____(填“能”或“不能”),原因是
_________________。
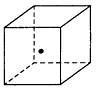
(3)如图立方体中心的“·”表示金刚石晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的碳原子。
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g) 计算该反应的反应热△H为
Si(s)+4HCl(g) 计算该反应的反应热△H为
__________。
参考答案:(1)>;<
(2)不能;物质熔点高低由构成物质的微粒 间作用力决定,单质Si属于原子晶体,原子间作用力是共价键,SiCl4分子间作用力是范德华力,比共价键弱得多,因此不能都根据键能来判断物质的熔点高低 (3)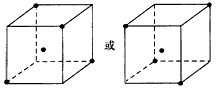 (4)+236kJ/mol
(4)+236kJ/mol
本题解析:
本题难度:一般