微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (2009天津六校二次联考,6)下列有关铁元素的叙述中正确的是(?)
A.氢氧化铁可以由相关物质通过化合反应而制得
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI====FeI3+3H2O
D.铁元素位于周期表的第四周期第ⅧB族
参考答案:A
本题解析:4Fe(OH)2+O2+2H2O====4Fe(OH)3,A正确;Fe和I2反应生成FeI2,B错;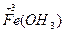 具有氧化性,反应为2Fe(OH)3+6HI====2FeI2+6H2O+I2,C错;铁元素位于周期表的第四周期第Ⅷ族,D错。
具有氧化性,反应为2Fe(OH)3+6HI====2FeI2+6H2O+I2,C错;铁元素位于周期表的第四周期第Ⅷ族,D错。
本题难度:简单
2、选择题 C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
A.反应后的固体混合物中还含有碳
B.反应后的固体混合物总质量为13.6 g
C.反应后的固体混合物中氧化物的物质的量为0.05 mol
D.反应后的固体混合物中单质Cu的质量为12.8 g
参考答案:BC
本题解析:n(C)=0.1mol,n(CuO)=0.2mol.n(CaCO3)=n(CO2)=" 5.00" g÷100g/mol= 0.05mol,n(CO)="1.12L÷" 22.4L/mol ="0.05mol," n(CO2)+ n(CO)=n(C)=0.1mol所以固体中无碳单质存在。气体中的氧元素的物质的量为n(O)= 2n(CO2)+ n(CO)=0.15mol< n(CuO)=0.2mol,所以固体中还含有0.05mol的Cu2O其质量为0.05mol×144g/mol=7.2g,,含有Cu的质量为(0.2mol-0.05mol×2)×64g/mol=6.4g.所以固体的总质量为7.2g+6.4g="13.6" g.故正确选项为B C。
本题难度:一般
3、选择题 下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁易锈蚀?②在人体的血红蛋白中含有铁元素③铁是地壳中含量最高的金属?④铁能在氧气中剧烈燃烧,但不能在水蒸气中反应?⑤能通过化合反应生成FeCl3和Fe(OH)3
A.①③
B.②④
C.②⑤
D.④⑤
参考答案:C
本题解析:
正确答案:C
①不正确,铁能被磁铁吸引,但纯铁抗蚀性很强?②正确;③不正确,铝是地壳中含量最高的金属?④不正确,铁能在氧气中剧烈燃烧,也能在水蒸气中反应生成Fe3O4和H2?⑤正确。能通过化合反应生成FeCl3和Fe(OH)3,2Fe+3Cl2=2FeCl3,4Fe(OH)2+O2+2H2O="4Fe" (OH)3
本题难度:一般
4、选择题 把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和SO42-的物质的量之比为
A.1∶4
B.2∶7
C.1∶2
D.8∶31
参考答案:A
本题解析:投入铁粉后发生的反应为Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu,由于残余固体的质量与原来加入的铁粉质量相等,因此置换出的铜和参加反应的铁的质量是相同的。若设置换出了xmol铜,则和铜离子反应的铁是xmol,则与氢离子反应的铁是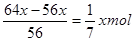 。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是
。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是 和xmol,所以原溶液中H+和SO42-的物质的量之比为
和xmol,所以原溶液中H+和SO42-的物质的量之比为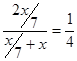 。所以答案是A。
。所以答案是A。
本题难度:一般
5、选择题 甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是
下列说法正确的是
A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
B.若甲为金属单质,乙为非金属单质,则甲只能是Mg
C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
参考答案:C
本题解析:A. 若甲是Al、Fe单质,丙是Fe2O3,则丁是Al2O3所属的物质类别是两性氧化物。错误。B 若甲为金属Fe,丙是H2O,乙为非金属单质H2,则丁是Fe3O4。错误。C.2C+SiO2 2CO↑+Si。正确。D若甲、乙元素是同周期元素,则该反应的化学方程式也可以为:Zn +CuO
2CO↑+Si。正确。D若甲、乙元素是同周期元素,则该反应的化学方程式也可以为:Zn +CuO ZnO + Cu.。错误。
ZnO + Cu.。错误。
本题难度:一般