微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中? B.空气氛围中? C.氩气氛围中? D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
?
符合表中的平衡常数x的数值是________(填字母序号)。
A.0? B.0.012? C.32.081? D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
?
| c(CO)
| c(H2)
| c(CH3OH)
|
0 min
| 0.8 mol·L-1
| 1.6 mol·L-1
| 0
|
2 min
| 0.6 mol·L-1
| y
| 0.2 mol·L-1
|
4 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
|
6 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
|
?
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂? B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
参考答案:(1)Cl2 2H2O+2e-=H2↑+2OH-
(2)进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净 C
(3)①B ②0.3 mol·L-1·min-1 62.5% A
(4)CH3OH+8OH--6e-=CO32—+6H2O
本题解析:(1)装置甲为电解饱和NaCl溶液的装置,阳极为Cl-失电子,被氧化为Cl2,阴极水电离的H+得电子,生成氢气和NaOH。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,H2的平均反应速率为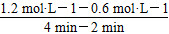 =0.3? mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3? mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为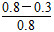 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
(4)装置己是由甲醇、氧气、NaOH溶液构成的燃料电池,负极反应为甲醇在碱性条件下失电子的反应。
本题难度:困难
2、计算题 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2。已知:
2H2(g)+O2(g)=2H2O(g)?△H= a? kJ·mol-1
N2(g)+2O2(g)=2NO2(g)?△H= b? kJ·mol-1
H2O(1)=H2O(g)?△H= c? kJ·mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的相对分子质量保持不变
E.1mol N≡N键断裂,同时1mol H—H键断裂
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。

参考答案:(16分)
(1)4NH3+5O2 4NO + 6H2O? (2分)?减小(2分)
4NO + 6H2O? (2分)?减小(2分)
(2)(2a—b—4c)kJ/mol (2分,不写单位扣1分)
(3)①B C D(3分)
②0.1mol/(L·min)? (2分,不写或写错单位0分)? 75%(2分)

(共3分,前10min的曲线1分;10~15min的曲线2分,到达平衡的时间应小于15min,NH3平衡浓度小于2.67 mol/L)
本题解析:(1)氨气具有还原性,与氧气在催化剂加热作用下发生反应,生成一氧化氮和水,该反应是氧化还原反应、可逆反应、放热反应,氮元素由—3升为+2价,氧元素由0降为—2价,根据最小公倍数法配平,则4NH3+5O2 4NO + 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=
4NO + 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=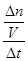 =
= 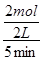 =0.2mol/(L?min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L?min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
=0.2mol/(L?min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L?min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
N2?+? 3H2? ?2NH3
?2NH3
起始浓度/ mol·L-1? x/2? y/2? 0
变化浓度/ mol·L-1? 1/2? 3/2? 1
平衡浓度/ mol·L-1? 1/2? 1/2? 1
则x/2—1/2=1/2,y/2—3/2=1/2,解得:x=2,y=4
氢气的平衡转化率= ×100%=
×100%=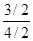 ×100%=75%。
×100%=75%。
画图要点:①t=0时,氨气浓度为0;t=5min,氨气浓度为1mol/L;0<t<5min时,氨气浓度逐渐增大;5min≤t<10min时,氨气浓度始终为1mol/L;②t=10min时,由于容器容积缩小1半,则反应物、生成物浓度立即增大一倍,则氨气浓度变为2mol/L;③缩小容器容积,就是增大压强,反应速率增大,达到平衡的时间大约是起始时达到平衡时间的一半,因此达到平衡的时间约为5/2min;若正反应能进行到底,氮气过量,4mol氢气最多可以生成8/3mol氨气,由于可逆反应不能进行到底,则浓度一定小于8/3mol/L≈2.67mol/L;10min<t≤12.5min时,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,所以氨气浓度从2mol/L逐渐增大到2.5mol/L左右;④12.5min<t≤15min时,氨气浓度始终为2.5mol/L左右。
本题难度:一般
3、选择题 可逆反应:2NO2?2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n?mol O2的同时生成2n?mol NO2;
②单位时间内生成n?mol O2?的同时,生成2n?mol?NO;
③用NO2、NO、O2?的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再改变的状态;?
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态.
A.①④⑥
B.②③⑤
C.①③④
D.①②③④⑤⑥
参考答案:此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.①符合特征(1);②表示的都是正反应方向;③说明了反应中各物质的转化量的关系;④NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2);⑤中若是恒容条件,则ρ始终不变;若恒压条件,则ρ随反应而变;⑥也说明符合特征(2).故①④⑥能说明是否达到平衡状态.
故选A.
本题解析:
本题难度:简单
4、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是( )
A.反应混合物的浓度
B.反应体系的压强
C.正、逆反应的速率
D.反应物的转化率
参考答案:A、如果混合物中各组分的浓度变化而保持各组分的含量不变时,平衡不移动,故A错误;
B、如果反应前后气体总物质的量不变,则压强对平衡无影响,故B错误.
C、使用合适的催化剂,正、逆反应速率都改变,但平衡不移动,故C错误;
D、只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 以下是反A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
A. v(A)="0.15" mol?L-1?s-1? B. v(B)="0.6" mol?L-1?s-1?
C. v(C)="0.4" mol?L-1?s-1? D. v(D)="0.45" mol?L-1?s-1
参考答案:D
本题解析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值即可。根据反应的方程式,如果都用物质B表示,则反应速率分别是0.45 mol/ (L·s)、0.6 mol/ (L·s)、0.6 mol/ (L·s)、0.675mol/ (L·s),答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的应试能力和学习效率。该题的关键是明确反应速率和化学计量数的关系。另外再进行反应速率的换算时,还要注意单位的统一。
本题难度:简单