微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质与硝酸银溶液相遇能产生白色沉淀的是 (?)
A.Cl2
B.CCl4
C.KClO3
D.AlCl3
参考答案:AD
本题解析:与硝酸银溶液产生的白色沉淀为AgCl,故Cl2和AlCl3都能满足,而四氯化碳很稳定,加入硝酸银溶液,只会分层;KClO3没有氯离子,故也不能产生沉淀。
点评:此题考核了AgCl的生成条件,难度不大。
本题难度:简单
2、选择题 在某些高档点心的包装盒内有个小纸袋,将小纸袋打开,可看到灰黑色粉末,其中有些已变成棕褐色.将灰黑色粉末溶于盐酸,取上层清液,滴入几滴氯水,再滴入KSCN溶液,马上出现红色.以下结论不?正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.小纸袋中可能装有活性铁粉
C.小纸袋中的原装粉末可能是Fe2O3
D.该灰黑色粉末不可食用
参考答案:C
本题解析:
本题难度:简单
3、计算题 (13分)将8.6 g的铜银合金完全溶于浓HNO3,若反应中硝酸的还原产物只有NO2和N2O4,且它们的体积均为1.12 L(标准状况),则该铜银合金中铜和银的质量分别为多少?
参考答案:3.2 g? 5.4 g
本题解析: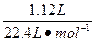 ="0.05" mol
="0.05" mol
设合金中Cu为x mol,Ag为y mol。则
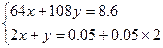 解得
解得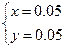
所以m(Cu)="64" g·mol-1×0.05 mol="3.2" g
m(Ag)="8.6" g-3.2 g="5.4" g
本题难度:简单
4、实验题 铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO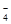 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO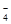 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
参考答案:(18分)(1)铁粉?氯气 (2分);4∶1(2分)
(2)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(2分)
FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-(2分)
(3)①250ml容量瓶和胶头滴管(2分);酸式滴定管?红(2分)
②将Fe3+还原成Fe2+(1分);Zn+2Fe3+=Zn2++2Fe2+(2分)?③11.2%(2分)?偏高(1分)
本题解析:(1)铁是变价金属,与强氧化剂反应生成+3价铁,与弱氧化剂反应生成+2价铁,所以在实验室中,FeCl2可用铁和盐酸反应制备,FeCl3可用铁粉和氯气反应制备。设样品中FeCl2和FeC13物质的量分别是x 和y,则根据混合物n(Fe)∶n(Cl)=1∶2.2可知,(x+y):(2x+3y)=1∶2.2,解得x∶y=4∶1。
(2)FeC13与KClO在强碱性条件下反应可制取K2FeO4,在反应中氯元素的化合价从+1价降低到—1价,得到2个电子。铁元素的化合价从+3价升高到+6价,失去3个电子,即还原剂与氧化剂的物质的量之比是2:3,因此该反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;原电池种正极得到电子,所以在K2FeO4-Zn碱性电池中,锌是负极,K2FeO4是正极,所以正极电极反应式为FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-。
(3)①配制一定物质的量浓度溶液时,除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有250ml容量瓶和定容的胶头滴管。由于高锰酸钾溶液极易强氧化性,且显酸性,所以步骤三滴定过程中盛装KMn4溶液的仪器名称为酸式滴定管;酸性高锰酸钾溶液显红色,所以滴入最后一滴溶液时,锥形瓶中溶液变为红色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②由于酸性高锰酸钾溶液也能把亚铁离子氧化生成铁离子,所以加入锌粉的作用是将Fe3+还原成Fe2+,反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+。
③两次实验中消耗0.0200 mol/L KMnO4溶液的平均值=(20.02 mL+ 19.98 mL)÷2=20.00ml,所以消耗高锰酸钾的物质的量是0.0200L×0.0200 mol/L=0.0004mol。根据电子得失守恒可知,溶液中亚铁离子的物质的量=0.0004mol×5=0.0020mol,所以该晶体中铁元素的质量分数为 ×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
本题难度:困难
5、选择题 铁粉投入下列物质的水溶液中,不能产生H2的是?
[? ]
A.NaHSO4?
B.HCl? ?
C.CH3COOH?
D.0.1mol/LHNO3?
参考答案:D
本题解析:
本题难度:简单