微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体电解质通过其中的离子迁移进行电荷传递,因此又称为固体离子导体,RbAg4I5晶体就是一种重要的固体电解质,其中发生迁移的物质全是Ag+。利用RbAg4I5晶体,可以制成电化学气敏传感器,如图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势的变化可以得知O2的含量。在气体传感器的工作过程中,下列变化肯定没有发生的是? ( )。
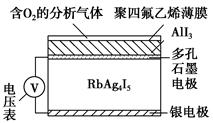
A.I2+2Rb++2e-=2RbI
B.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+
D.4AlI3+3O2=2Al2O3+6I2
参考答案:A
本题解析:该装置工作时属于原电池,负极是银电极,银失去电子变成Ag+,C正确;O2在透过聚四氟乙烯薄膜时可能会有部分O2与AlI3反应,部分I-被氧化成I2,D正确;生成的单质碘遇到Ag+(移向正极)又得到电子转化为AgI,B正确;Rb+不会迁移到正极上,A错误。
本题难度:一般
2、选择题 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH+3O2== 2CO2+3H2O,电池示意如下图,下列说法不正确的是
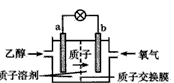
[? ]
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ +O2+4e-==2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
参考答案:D
本题解析:
本题难度:一般
3、填空题 (10分)(1)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________?。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g)?△H="+67.7" kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则肼与二氧化氮反应的热化学方程式为:?
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为?;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为?
参考答案:(1)生成Cu(OH)2沉淀(填化学式),离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
(2)肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol?
(3)正极反应式为O2+4e-+4H+=2H2O;负极反应式为H2-2e-+2OH-=2H2O
本题解析:(1)由两沉淀的Ksp可知,在c(Mg2+)与c(Cu 2+)相同的情况下, Cu(OH)2的离子积首先超过Ksp,先析出沉淀:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
(2)肼与二氧化氮反应的化学方程式为:2N2H4+2NO2=3N2+4H2O,再根据盖斯定律2×②-①可知:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol
(3)酸式氢氧燃料电池:由总反应式减去负极反应式可得到正极反应式:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池:由总反应式减去正极电极式可得负极反应式:H2-2e-+2OH-=2H2O
本题难度:一般
4、填空题 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
参考答案:(1)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)ac (3)50% 0.25 cd (4)CH3OCH3+3H2O-12e-=2CO2+12H+, 0.5
本题解析:由已知的方程式①×2+④得2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)由反应①可知ac说明反应达平衡状态。
(3)根据反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1当放热为49k J时消耗甲醇
4mol 4mol 2mol 2mol
结合平衡常数k=c(CH3OCH3)c(H2O)/
C2(CH3OH)得0.25,当再冲入2mol甲醇时化学平衡不会移动且平衡常数不变,确定C对,压强为原来的1.25倍。
(4)电解质为酸性电池的负极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+,正极反应式为
4H++O2+4e-=4H2O,消耗2.8L氧气时转移电子为0.5mol。
考点:盖斯定律、化学平衡状态的标志、化学平衡常数、原电池原理、电子反应式的书写。
本题难度:困难
5、选择题 右图是某学生设计的一个原电池,若要装置中电流计发生偏转,
则M、N两极的组成材料是

A.Zn、Zn
B.Zn、Cu
C.Cu、Cu
D.石墨、石墨
参考答案:B
本题解析:电流计指针要发生转动,说明必须有电流通过,两极材料存在活泼性差异,所以应该选择B。
本题难度:简单