微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 放射性元素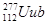 的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是(?)
的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是(?)
A.每次衰变都放出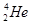
B.每次衰变都放出T
C.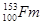 只是元素镄的一个原子,153不代表镄元素的相对原子质量
只是元素镄的一个原子,153不代表镄元素的相对原子质量
D.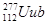 经过3次这样的衰变是得不到镄原子的,产生的是Uub的同位素原子
经过3次这样的衰变是得不到镄原子的,产生的是Uub的同位素原子
参考答案:A
本题解析: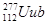 经过6次衰变得到
经过6次衰变得到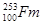 号元素,每次放出相同的粒子,所以每次衰变放出的粒子是
号元素,每次放出相同的粒子,所以每次衰变放出的粒子是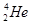 。153是Fm的中子数不是质量数,所以应表示为
。153是Fm的中子数不是质量数,所以应表示为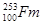 而不是
而不是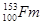 。
。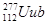 经过3次衰变后,虽然得到的不是镄原子,但由于质子数发生改变也得不到Uub的同位素。答案选A。
经过3次衰变后,虽然得到的不是镄原子,但由于质子数发生改变也得不到Uub的同位素。答案选A。
点评:元素符号左上角的数字表示质量数,质量数=质子数+中子数。
本题难度:简单
2、填空题 下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
一
| ①
| ?
| ?
|
二
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
三
| ⑥
| ?
| ⑦
| ?
| ?
| ⑧
| ⑨
| ⑩
|
(1) 在这些元素中,化学性质最不活泼的是:?(填元素符号)。
(2) 元素②和③非金属性较弱的是___________(填元素符号),画出元素③原子结构示意图_______________________。
(3) ④和⑧气态氢化物的稳定性较强的是_____________(填化学式)。
(4) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________,碱性最强的化合物的电子式是___________________。
(5)用电子式表示元素①和⑤所形成化合物的形成过程:________________________。
(6)⑤⑥⑦三种元素分别形成的单核离子半径由大到小顺序为________________(填离子符号)。
(7)元素①和④按原子个数比1:1形成的化合物分解的化学方程式_________________。
(8)写出元素⑦和⑨最高价氧化物的水化物之间反应的离子方程式_________________。
参考答案:(1) Ar ?(2) C?氮的原子结构示意图(略)?
(3)H20? (4) HClO4?氢氧化钠的电子式(略)(
(5) 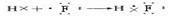 ?(6)F- >Na+?>? Al3+
?(6)F- >Na+?>? Al3+
(7)2H2O2===2H2O+O2↑(加热或用二氧化锰作催化剂都可以 )
(8)Al(OH)3+3H+==Al3+ +3H2O
本题解析:略
本题难度:简单
3、选择题 4p轨道电子排布达到半充满的元素,其原子序数是
A.15
B.33
C.35
D.51
参考答案:B
本题解析:根据核外电子排布规律可知,15、33、35、51的核外电子排布分别是1s22s22p63s23p3、1s22s22p63s23p63d104s24p3、1s22s22p63s23p63d104s24p5、1s22s22p63s23p63d104s24p64d105s25p3,所以4p轨道电子排布达到半充满的元素是33号元素As元素,答案选B。
本题难度:一般
4、选择题 现有四种元素的基态原子的核外电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3?③1s22s22p3④1s22s22p5
则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
参考答案:A
本题解析:四种元素的基态原子的核外电子排布式如下①1s22s22p63s23p4 ②1s22s22p63s23p3?③1s22s22p3④1s22s22p5,所以①②③④分别为Si、Al、N、F,故第一电离能为④>③>②>①,Al的第一电离能比Si大,因为其为半充满状态,故A正确;原子半径为②>①>③>④,故B错误;电负性为:④>③>①>②,故C错误;F无正的化学价,故最高正化合价为③>①>②>④,故D错误。
点评:本题考查了元素周期表、元素周期律,该知识的是高考考查的重点和热点,本题难度中等。
本题难度:一般
5、选择题 下列针对H3O+的说法中正确的是(?)
A?中心原子上的孤电子对数为2?
B? O原子采用sp2杂化,空间构型为三角锥形
C?离子中存在配位键?
D?纯水呈中性,纯水中不存在H3O+微粒
参考答案:C
本题解析:H3O+的中心原子上的孤电子对数为(6-1-1×3)÷2=1,所以是三角锥形,氧原子是sp3杂化,A、B不正确。在溶液中氢离子是以H3O+的形式存在,D不正确。氧原子含有孤对电子,提供给氢离子,所以含有配位键,选项C正确。
本题难度:简单