微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上制取硝酸铵的流程图如下,请回答下列问题:
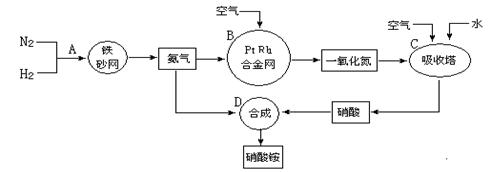
(1)在上述工业制硝酸的生产中,B设备的名称是?,其中发生反应的化学方程式为?。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是?。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

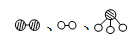 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是?、?。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是?、?。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是?;在合成硝酸的吸收塔中通入空气的目的是?。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2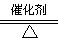 ?7N2+12H2O(NO也有类似的反应)
?7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是?。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率 是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 ?%。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
?
2、选择题 一定质量的铁铝合金完全溶于过量的热浓硝酸中,反应中共产生13.44LNO2(标况下),若在反应后的溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量不可能为
A.7.8g
B.15.6g
C.21.4g
D.10.7g
3、计算题 为了测定某铜银合金的成分,将30.0 g合金溶于80 mL 13.5 mol·L-1的浓硝酸中,待合金完全溶解后,收集到6.72 L(标准状况)气体,并测得溶液的c(H+)="1.00" mol·L-1,假设反应后溶液的体积仍为80 mL,试计算合金中银的质量分数。
4、选择题 某溶液100mL,其中含硫酸0.01mol,硝酸0.04mol,若在该溶液中投入1 .92g铜粉微热,反应后放出一氧化氮气体约为
.92g铜粉微热,反应后放出一氧化氮气体约为
A.0.02 mol
B.0.01 mol
C.0.015 mol
D.无法计算
5、计算题 (4分)6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为?mol
(2)求生成的气体中NO2和NO的物质的量共为?mol (用含有a的式子表示)