证明非金属性:Cl > C
参考答案:B
本题解析:A不正确,SO2具有还原性,使酸性高锰酸钾溶液褪色。在CO2中无法点燃CO,应该通过炽热的铜网除去CO,C正确。应该用氯元素的最高价含氧酸和碳酸钠反应进行验证,D不正确。所以只有选项B是正确的。答案选B。
本题难度:简单
2、选择题 实验室用已知浓度的盐酸标准溶液滴定未知浓度的NaOH溶液,下列操作导致中和滴定实验结果偏高的原因是(?)
A.盛标准液的滴定管尖嘴部位有气泡,在滴定时气泡消失
B.酸式滴定管读数时,滴定前仰视,滴定终了时又俯视
C.量取待测液的滴定管,用水洗后,未用待测液润洗
D.滴定时用的锥形瓶中加入待测液后又加少量水稀释
参考答案:A
本题解析:A:气泡的体积显示为标准溶液的体积,使其偏大,最终测定结果偏高
B:两次错误操作均导致标准溶液的体积偏小,测定结果偏低
C:滴定管未润洗,导致待测溶液浓度偏小,标准溶液体积偏小,测定结果偏低
D:不影响测定结果
答案为A
本题难度:一般
3、选择题 下列实验操作正确的是
A.用滤纸称量氢氧化钠固体
B.用酸式滴定管取10.01ml 的0.1mol/L的碳酸钠溶液
C.用稀氨水清洗做过银镜反应的试管
D.用淀粉KI试纸检验Cl2要湿润试纸,用pH试纸测量溶液pH前试纸不能湿润
参考答案:D
本题解析:氢氧化钠具有腐蚀性,且易吸水,应该放在烧杯中称量,A不正确;碳酸钠溶液显碱性,应该用碱式滴定管量取,B不正确;单质银不能溶于氨水中,C不正确,应该用硝酸洗涤,所以正确的答案选D。
点评:该题是高考中的常见题型,属于实验考查中基础性知识的考查。本题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
4、实验题 研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(g)+H2SO4(浓)====Na2SO4+SO2↑+H2O,制备SO2气体。
(2)有一小组在实验中发现,SO2产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。
请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因:____________________,
验证方法:________________________________________。
②原因:____________________,
验证方法:________________________________________。
③原因:____________________,
验证方法:________________________________________。
参考答案:①Na2SO3变质 取待测试样于试管中,加入适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
②不是浓H2SO4 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
本题解析:Na2SO3易氧化变质;SO2在水中有较大溶解度,应选较浓硫酸以减小SO2的溶解损失。
本题难度:简单
5、实验题 (12分)用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________
(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是__________________________?。
(3)第⑤步实验的操作是________________?。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中___________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________?
D.定容时俯视刻度线________________?
参考答案:(1)16.7ml? B
(2)先向烧杯加入30ml(或适量)蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌
(3)继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止、塞进瓶塞,反复颠倒摇匀
(4)A.偏小? B.无影响? C.偏小? D.偏大
本题解析:(1)根据稀释过程中溶质不变可知,需要浓硫酸的体积是
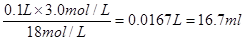 。量筒的规格越近16.7ml,误差越小,所以选择的量筒是25ml的,即答案选B。 。量筒的规格越近16.7ml,误差越小,所以选择的量筒是25ml的,即答案选B。
(2)浓硫酸溶于水放出大量的热,且硫酸的密度大于水的,所以稀释浓硫酸的正确操作是:先向烧杯加入30ml(或适量)蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌。
(3)定容时需要胶头滴管,所以正确的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止、塞进瓶塞,反复颠倒摇匀。
(4)根据c=n/V可知,浓硫酸具有吸水性,长时间放置,浓度变稀,配制的浓度就偏小;容量瓶中含有蒸馏水,不影响配制的浓度;烧杯、玻璃棒没有洗涤,则溶质减少,浓度偏低;定容时俯视刻度线,则容量瓶中溶液的体积偏少,则浓度偏大。
本题难度:一般
|