微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是( )
A.金属元素的最外层电子数不一定小于4
B.最外层电子数为3的元素不一定是主族元素
C.同主族第三、第四周期的元素原子序数之差不一定等于18
D.若存在简单阴离子R2-,则R一定属于VIA族
参考答案:A、金属元素的最外层电子数大多数小于4,但部分元素的最外层电子数大于或等于4,如铋、钋等,故A正确;
B、最外层电子数为3的元素一定是主族元素,ns能级能量小于(n-1)d能级能量,导致元素最外层电子数小于或等于2,故B错误;
C、同主族第三、第四周期的元素原子序数之差不一定等于18,可能等于8,如Na和K元素的原子序数等于8,故C正确;
D、简单阴离子最外层电子排布是ns2np6(H元素除外),若存在简单阴离子R2-,说明R元素得2个电子达到稳定结构,所以R一定属于VIA族,故D正确.
故选B.
本题解析:
本题难度:简单
2、简答题 ①②③④⑤⑥六种元素,在元素周期表中的位置如图所示.回答下列问题:
(1)六种元素中,金属性最强的元素位置位于元素周期表______,该元素的单质与水反应的离子方程式为______.
(2)元素①和②可以形成众多的化合物,其中最简单的是(写电子式)______,与该化合物电子总数相同的三原子分子的结构式为______.
(3)画出元素③的原子结构示意图______,该元素形成的气态氢化物通常极易溶解于水,其原因是______.
(4)写出元素④、⑥的最高价氧化物对应水化物相互反应的离子方程式为______.
参考答案:(1)周期表中,同周期元素从左到右元素的金属性逐渐减弱,同主族元素从上到下元素的金属性逐渐增强,则金属性最强的元素应为Na,位于第三周期ⅠA族,该元素的单质与水反应的离子方程式为2H2O+2Na═2Na++2OH-+H2↑,
故答案为:第三周期ⅠA族;2H2O+2Na═2Na++2OH-+H2↑;?
(2)①和③可以形成众多的化合物为烃类化合物,最简单的物质为CH4,其电子式为
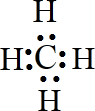
.与CH4电子总数相同的三原子分子是H2O,其结构式为H-O-H.
故答案为:
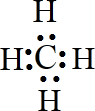
;H-O-H;
(3)元素③为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为
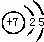
,该元素形成的气态氢化物为NH3,NH3是极性分子,能与水反应,与水分子能形成氢键,所以,通常极易溶解于水.
故答案为:
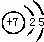
;NH3是极性分子,能与水反应,与水分子能形成氢键;
(4)元素④、⑥的最高价氧化物分别为NaOH、HClO4,为强碱、强酸,离子反应方程式为H++OH-═H2O,
故答案为:H++OH-═H2O.
本题解析:
本题难度:一般
3、选择题 A、B、C三种短周期元素在周期表中的相对位置如下图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是?

[? ]
A. B与C均不存在同素异形体
B. X一定是酸性氧化物
C. B的氢化物比A、C的氢化物稳定
D. Y与NaOH溶液反应只能生成两种盐
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列排顺序有错误的是
A.离子半径:S2->Cl->K+>Ca2+
B.热稳定性:HI<HBr<HCl<HF
C.最高正化合价:C<N<O<F
D.碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH
参考答案:C
本题解析:
本题难度:困难
5、推断题 V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是___________;写出X、Z两种元素组成的化合物的一种用途:__________
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式:________________________
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH
____(填“大于”“小于”或“等于”)7。
(4)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
______________________。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式:__________________;放电时溶液中H+移向_______(填“正”或 “负”)极。
(6)W(s)+O2(g)=WO2(g) △H1;W(g)+O2(g)=WO2(g) △H2 则△H1___(填“>”“<”或“=”)△H2。
参考答案:(1)第2周期VA族;绿色氧化剂(H2O2)或溶剂(H2O)
(2)3NO2+H2O=2HNO3+NO
(3)小于
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
(5)N2+6e-+8H+=2NH4+;正
(6)>
本题解析:
本题难度:一般