微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的( )
A.NaNO3溶液
B.NaCl固体
C.Na2SO4溶液
D.CuSO4粉末
2、简答题 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g)

2NO2?(g),如图所示.
(1)曲线______?(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若升高温度,则v(正)______,v(逆)______(填“加快”或“减慢”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲
中v(NO2)=0.3mol?L-1?min-1,乙中v?(N2O4)=0.2mol?L-1?min-1,则______中反应更快.
(4)在0到1min中内用X表示该反应的速率是______,该反应达最大限度时,Y的转化率______,反应开始时与反应达平衡状态时的压强之比为______.
(5)下列描述能表示反应达平衡状态的是______.
A.容器中X与Y的物质的量相等B.容器内气体的颜色不再改变
C.容器的压强保持一定D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1mol?N2O4完全转化为2mol?NO2?(g)时吸收QKJ的热量,在一密闭容器中充入2mol?NO2?(g),容器内温度______(升高、降低或不变).达到反应限度时反应产生的热量______QKJ(大于、小于或等于).
3、选择题 10mL浓度为1mol?L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的3mol?L-1的硫酸
B.加入适量蒸馏水
C.加入数滴硫酸铜溶液
D.加入适量的硫酸钠溶液
4、实验题 控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙状态
| c(HCl)/mol·L-1
| 溶液温度/oC
| 碳酸钙消失时间/s
|
反应前
| 反应后
|
1
| 粒状
| 0.5
| 20
| 39
| 400
|
2
| 粉末
| 0.5
| 20
| 40
| 60
|
3
| 粒状
| 0.6
| 20
| 41
| 280
|
4
| 粒状
| 0.8
| 20
| 40
| 200
|
5
| 粉末
| 0.8
| 20
| 40
| 30
|
6
| 粒状
| 1.0
| 20
| 40
| 120
|
7
| 粒状
| 1.0
| 30
| 50
| 40
|
8
| 粒状
| 1.2
| 20
| 40
| 90
|
9
| 粒状
| 1.2
| 25
| 45
| 40
|
分析并回答下列问题:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。
(2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。
(4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。
5、填空题 某密闭容器中有如下可逆反应:2SO2(g)+O2(g)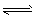 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
(1)升高温度,v(正)___________,v(逆)___________,SO2 的转化率_____________。
(2)加正催化剂,v(正)___________,v(逆)___________,O2 的物质的量___________。
(3)缩小容器的体积,SO3的物质的量___________,SO2的转化率______________。