微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)现有电解质溶液:①Na2CO3?②NaHCO3?③CH3COONa?④ NaOH
(1)当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是?(填编号,以下相同)
(2)在上述四种电解质溶液中,分别加入AlCl3溶液,无气体产生的是?
参考答案:4分(每空2分共4分)
(1)?③②①④?(2)③④
本题解析:略
本题难度:一般
2、计算题 燃烧6g碳全部生成气体时放出的热量,如果全部被水吸收,可使1kg水由20℃升高到67℃,水的比热容为4.2kJ·(kg·℃)-1,求碳的燃烧热?
参考答案:394.8 kJ/mol
本题解析:1kg水由20℃升高到67℃,则需要吸收的热量是1000g×4.2kJ·(kg·℃)-1×(67℃-20℃)=197400J=197.4kJ。6g是0.5mol,又因为燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以碳的燃烧热是197.4kJ/mol×2=394.8 kJ/mol。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识对训练,主要是考查学生对燃烧热概念的熟悉了解程度,有助于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。
本题难度:简单
3、选择题 下列说法正确的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO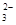 )+c(HCO
)+c(HCO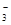 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的
c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10,? Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
A.①④
B.②③
C.①③
D.②④
参考答案:C
本题解析:①两者的浓度之比等于物质的量之比,稀释时,促进碳酸氢根离子的电离和水解,碳酸氢根离子的物质的量减小,钠离子的物质的量不变,故两者的比值增大,①正确;②溶液中含碳的微粒还有碳酸分子,故②错误;③恰好完全中和时生成氯化铵溶液,溶液中的氢离子是水电离出的,由水电离出的氢离子等于由水电离生成的氢氧根离子,故③正确;④有Ksp的表达式可以求出溶液中离子的浓度,根据离子浓度比较,重铬酸钾溶液中离子浓度大,故溶解度大,④错误;故选C。
本题难度:一般
4、选择题 下列水溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.c(H+) =c(OH-)
D.pH=3的与pH=11的碱等体积混合后的溶液
参考答案:C
本题解析:溶液的酸碱性是由c(H+)与c(OH-)的相对大小决定的
本题难度:简单
5、选择题 已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1