微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A.HF与CaCl2反应产生沉淀
B.25℃时0.2mol·L-1HF溶液中pH=2
C.Ksp(CaF2)随温度和浓度的变化而变化
D.该体系中最终没有氟化氢分子
参考答案:A
本题解析:混合后氟离子和钙离子的浓度分别是6×10-3mol/L和0.1mol/L,此时c(F-)2·c(Ca2+)=3.6×10-5>.46×10-10,所以能产生沉淀,A正确。25℃时0.2mol·L-1HF溶液中氢离子浓度是8.5×10-3mol/L,B不正确。溶度积常数只与温度有关系,C不正确。氟化氢是弱电解质,始终存在电离平衡,即溶液中一定含有氟化氢分子,D不正确,答案选A。
本题难度:一般
2、填空题 某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
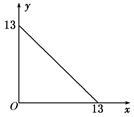
(1)此温度下,水的离子积KW为________,则该温度t__________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=______________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
参考答案:(1)1×10-13 > 碱 (2)①10∶1 ②9∶2
本题解析:(1)由图知KW=1×10-13>10-14,则t>25℃,中性时pH=6.5,当pH=7时溶液呈碱性;(2)pH=11的NaOH溶液中[OH-]=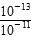 =10-2mol·L-1,溶液呈中性时,n(H+)=n(OH-)即10-1×b=10-2×a,a∶b=10∶1;若混合液pH=2,则
=10-2mol·L-1,溶液呈中性时,n(H+)=n(OH-)即10-1×b=10-2×a,a∶b=10∶1;若混合液pH=2,则 =10-2,得a∶b=9∶2。
=10-2,得a∶b=9∶2。
本题难度:一般
3、选择题 25℃时,将稀氨水逐滴入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-)
B.c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-)
D.c(SO42-)+ c(OH-)= c(NH4+)+ c(H+)
参考答案:C
本题解析:将稀氨水逐滴入到稀硫酸中,等体积时显酸性,当溶液的pH=7,碱过量。c(NH4+)>c(SO42-) 、2 c(SO42-)+ c(OH-)= c(NH4+)+ c(H+)
本题难度:简单
4、填空题 以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) ?c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为?
?
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH2??14
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系?
参考答案:(1)c(Na+)﹤? c(CH3COO-)(2) c(Cl-)=c(Na+)﹥c(H+)﹥c(CH3COO-)﹥c(OH-)?
(3)pH1+ pH2?﹤? 14 (4)V1、V2、V3的大小关系? V3﹥ V1 =V2
本题解析:(1)pH相同的弱酸与强碱等体积混合,溶液最终显酸性,c(H+)> c(OH—),由电荷守恒知另两离子浓度必然是:c(Na+)﹤?c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合后即是等浓度的NaCl和CH3COOH溶液,NaCl全部电离,CH3COOH部分电离,溶液显酸性。
即:c(Cl-)=c(Na+)﹥c(H+)﹥c(CH3COO-)﹥c(OH-)
(3)可以用假设法更直接。假设NaOH溶液的pH为11、NH4Cl溶液的pH则为3,
如果同时稀释10倍,则NaOH溶液的pH为12,而NH4Cl溶液由于有水解平衡的存在,其pH则就略小于4,故pH1+ pH2?﹤?14
(4)两强碱溶液中OH—浓度相同,必然消耗相同的酸,故V1 =V2,?而弱碱里面存有电离平衡,必然要消耗更多的酸,所以V3﹥ V1 =V2
本题难度:一般
5、选择题 下列操作对滴定结果无影响的是(?)
A.盛待测液的锥形瓶先用待测液润洗
B.滴定管尖嘴部分有气泡,滴定结束后气泡消失
C.滴定管在滴定前液面在0刻度以下
D.达到滴定终点时俯视读取滴定管内液体体积
参考答案:C
本题解析:锥形瓶不能用待测液洗涤,否则浓度偏大,A不正确。B中相当于标准液的体积偏多,测定结果偏高,B不正确。俯视读数滴定管,读数偏低,测定结果偏低,答案选C。
本题难度:一般