|
高中化学必备知识点《化学反应与能量》高频试题预测(2017年最新版)(六)
2017-08-01 01:00:43
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。下列关系中正确的是
A.2E1=E2
B.2E1>E2
C.2E1<E2
D.E1=E2
|
参考答案:B
本题解析:氢气分子分解成原子,是吸热反应,则2E1>E2 ,选项B正确。
考点:考查化学键和吸热、放热反应间的关系。
本题难度:一般
2、选择题 下列每组中各物质内既有离子键又有共价键的一组是
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
参考答案:C
本题解析:A、NaOH 含有离子键和极性共价键; H2SO4 只含有共价键;(NH4)2SO4含有离子键和共价键,故A错误。
B、MgO 只含离子键;Na2SO4 含离子键和共价键;HNO3只含有共价键,故B错误。
C、Na2O2、KOH、Na3PO4含离子键和共价键,故C正确。
D、HCl只含共价键;Fe2O3 、MgCl2只含离子键,故D错误。
故选C。
点评:1、离子化合物中可能含有极性共价键2,如KOH;也可能含有非极性共价键,如Na2O2;2、共价化合物中一定不含离子键。
本题难度:简单
3、选择题 下列说法中,不正确的是(?)
A.双原子分子中的共价键,一定是极性键
B.非极性键也可能存在于离子化合物中
C.物理变化可能破坏化学键
D.离子化合物在固态时不能导电
参考答案:A
本题解析:A、双原子分子中的共价键也可能是极性键,如HF,故A错误。故选A。
点评:题考查了化学键与物质的关系,要注意:双原子分子不仅可能是单质还可能是化合物。
本题难度:简单
4、选择题 已知N5AsF6是离子化合物,其中阳离子是N5+。下列叙述错误的是(?)
A.N5+具有34个电子
B.N5+中氮-氮之间是以共价键结合
C.化合物N5AsF6中As的化合价为+1
D.化合物N5AsF6中F的化合价为-1
参考答案:C
本题解析:氮元素的原子序数为7,每个N原子核外有7个电子,则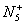 共有核外电子:5×7-1=34个,A正确; 共有核外电子:5×7-1=34个,A正确;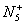 是由同种非金属元素结合而成的,则氮氮原子间一定是共价键,B正确;由于N5+为+1价,则[AsF6]-,F只有-1价,则As为+5价,所以D正确,C错误。故本题选C。 是由同种非金属元素结合而成的,则氮氮原子间一定是共价键,B正确;由于N5+为+1价,则[AsF6]-,F只有-1价,则As为+5价,所以D正确,C错误。故本题选C。
点评:本题考查原子核外电子的排布规律,化学键的相关知识,元素化合价的计算,综合性较强,题目难度中等。
本题难度:简单
5、简答题 有下列六种固体物质:①氯化镁、②金刚石、③白磷、④过氧化钠、⑤干冰、⑥二氧化硅,请回答有关这六种固体物质的问题.
(1)将这六种固体按不同晶体类型分成三组,并填写下表:
(2)其中以共价键相结合,原子彼此间形成空间网状结构的化合物是______(填编号).晶体内存在分子的单质是______(填编号).含有共价键的离子化合物是______;
(3)其中硬度最大的物质是______(填编号);熔点最低的物质是______(填编号).
(4)请写出氯化镁的电子式______,干冰的结构式______.
参考答案:(1)①氯化镁由阴阳离子构成,是离子晶体;
②金刚石由原子构成,是原子晶体;
③白磷由分子构成,是分子晶体;
④过氧化钠由阴阳离子构成,是离子晶体;
⑤干冰由分子构成,是分子晶体;
⑥二氧化硅由原子构成,是原子晶体;
故答案为:①④、②⑥、③⑤;?
(2)以共价键相结合,原子彼此间形成空间网状结构的是金刚石和二氧化硅,金刚石是单质,二氧化硅是化合物;
分子晶体内存在分子,白磷是单质,干冰是化合物;
过氧化钠晶体中过氧根离子和钠离子之间的化学键是离子键,氧原子和氧原子之间的化学键是非极性共价键,所以过氧化钠中存在离子键和共价键.
故答案为:⑥;③;④.
(3)原子晶体硬度大,金刚石的硬度最大;分子晶体的熔点较低,但标况下白磷是固体,二氧化碳是气体,所以干冰的熔点低.
故答案为②;⑤.?
(4)氯化镁阴阳离子间的作用力是离子键,所以氯化镁的电子式为
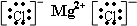
;干冰中原子间的作用力是极性共价键,所以干冰的结构式为O=C=O,
故答案为:
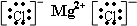
;O=C=O,
本题解析:
本题难度:一般
|