微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关物质的性质和该性质的应用均正确的是( )
A.常温下浓硫酸能使铝发生钝化,则在常温下可用铝制容器储运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
参考答案:A
本题解析:A.在常温下浓硫酸遇Fe、Al能使铝金属在表面产生一薄层致密的氧化物薄膜,对内层的金属起到保护作用,从而阻止了内层的金属继续发生反应。这种现象叫钝化,因此在常温下可用铝制容器储运浓硫酸。正确。B. 石英的主要成分是SiO2,SiO2与硫酸、硝酸等酸不能发生反应,但却能与HF发生反应。SiO2+4HF=SiF4↑+2H2O.因此不能用石英制造耐酸容器。错误。C. MgO和Al2O3都是离子化合物,熔点很高在工业上用于制作耐高温材料;在金属的冶炼时通常用电解法MgCl2、Al2O3冶炼镁、铝金属。错误。D.如果在海轮外壳上装若干铜块,这样Cu—Fe及海水构成了原电池,由于铜的金属活泼性比铁的差,Fe作原电池的负极,Cu作正极,能使轮船的腐蚀速度加快。错误。
本题难度:一般
2、推断题 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,B、C、D 三种元素原子的最外层电子数之和与A-的核外电子总数相等。E与其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应。根据以上信息,回答下列问题:
(1)A_______B_______C_______D_______E_______。(填元素符号)
(2)C、D的最高价氧化物的水化物相互反应的离子方程式是_____________________。C的最高价氧化物与B的最高价氧化物的水化物相互反应的化学方程式是________________________。
(3)用电子式表示E与A形成化合物的形成过程:____________________________。
参考答案:(1)A:F;B:Na;C:Al;D:S;E:Ca
(2)2Al(OH)3+3H2SO4==Al2(SO4)3+6H2O;Al2O3+2NaOH==2NaAlO2+H2O
(3)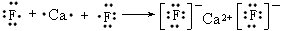
本题解析:
本题难度:一般
3、简答题 I.如图是由Emil?Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______.
(2)Fe的周期位置______
(3)用电子式表示元素a、g形成化合物的形成过程______;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式______
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式______.
(6)a元素与碳元素形成分子的空间结构可能是(填序号)______.

(7)请设计实验比较e?f?的金属性强弱(要求有操作、现象、结论)______.
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为______.
参考答案:(1)把H放在第ⅦA族,则H元素的最低化合价为-1价,则NaH为离子化合物,电子式为Na+[:H]-,故答案为:Na+[:H]-;
(2)铁元素在第四周期,在周期表中的第8列,即第四周期第VIII族,故答案为:第四周期第VIII族;
(3)硫化氢是由硫原子和氢原子间通过共用电子对形成的共价化合物,其形成过程表示为
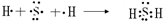
,故答案为:
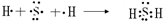
;
(4)由周期表可知,b为N元素,b元素的氢化物氨气与其最高价氧化物的水化物硝酸可生成一种盐为硝酸铵,即NH3+HNO3═NH4NO3,故答案为:NH3+HNO3═NH4NO3;
(5)d的最高价氧化物氢氧化钠和f的单质铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碳原子和氢原子之间形成的化合物甲烷是正四面体结构,苯是平面六边形结构,故答案为:cd;
(7)比较镁和铝金属活泼性强弱的方法:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱,故答案为:取大小相等的镁条和铝条,加入到相同浓度的盐酸中,观察产生氢气的快慢,最先产生氢气的金属活泼性强,反之活泼性弱;
(8)d为钠,d的某化合物呈淡黄色,则该化合物为过氧化钠,具有氧化性,沉淀和气体的物质的量之比为2:1,发生的反应为3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-,
故答案为:3Na2O2+4H2O+2Fe2+═2Fe(OH)3+O2↑+6Na++2OH-.
本题解析:
本题难度:一般
4、选择题 下列物质中,既能与盐酸又能与的是
A.氢氧化铝
B.硅酸钠
C.碳酸钠
D.二氧化硅
参考答案:A
本题解析:A项:氢氧化铝是两性氢氧化物,既能与盐酸又能与NaOH溶液反应,故对。B、C项:只能与盐酸反应而不能与NaOH溶液反应,故错。D项:只能NaOH溶液与反应而不能与盐酸反应,故错。故选A。
点评:本题综合考查了无机物之间反应的知识,涉及到的反应都源自于教材中,学生要注重对教材知识的学习。
本题难度:一般
5、选择题 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):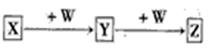 ,下列说法不正确的是
,下列说法不正确的是
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可生成Y
C.若X是金属铝,则W可能是NaOH溶液
D.若X是甲醇,则X、的相对分子质量可能相差14
参考答案:C
本题解析:A、若W是单质铁,X是氯气,则Y是氯化铁,氯化铁与铁反应生成氯化亚铁,因此Z溶液可能是FeCl2溶液,A正确;B、若W是氢氧化钠,则X可能是铝盐,Y是氢氧化铝,Z是偏铝酸盐,所以X与Z可生成Y,B正确;C、若X是金属铝,W是NaOH溶液,则Y是偏铝酸钠,偏铝酸钠与金属铝不反应,C不正确;D、若X是甲醇,则W可能是氧气,Y是甲醛,Z是甲酸,则X、Z的相对分子质量可能相差14,D正确,答案选C。
本题难度:一般