微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用100ml?0.3mol/L的盐酸和300ml?0.25mol/L的硫酸混合后加水稀释到500ml,混合液中H+物质的量浓度为
A.0.26mol/L
B.0.36?mol/L
C.0.45?mol/L
D.0.56?mol/L
参考答案:B
本题解析:分析:0.3mol/L的盐酸中氢离子浓度为0.3mol/L,0.25mol/L的硫酸溶液中氢离子浓度为0.5mol/L,混合后溶液中等氢离子为盐酸与硫酸含有的氢离子之和,据此计算.
解答:0.3mol/L的盐酸中氢离子浓度为0.3mol/L,0.25mol/L的硫酸溶液中氢离子浓度为2×0.25mol/L=0.5mol/L,混合后溶液中等氢离子为盐酸与硫酸含有的氢离子之和,令混合后氢离子浓度为c,则:
0.1L×0.3mol/L+0.3L×0.5mol/L=0.5L×c,
解得c=0.36?mol/L,
故选B.
点评:本题考查物质的量浓度的有关计算,难度不大,注意对公式的理解越灵活运用.
本题难度:简单
2、选择题 下列说法中正确的是
A.氢键是一种特殊的化学键,它广泛地存在于自然界中
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.有分子构成的物质中一定含有共价键
D.形成共价键的元素不一定是非金属元素
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列变化既有化学键的破坏又有化学键的形成的是
A.碘升华
B.冰融化
C.浓盐酸挥发
D.NH4Cl受热分解
参考答案:D
本题解析:A、B均属于属于物理变化,化学键既没有被破坏,也没有形成化学键。C也是物理变化,没有破坏化学键,但形成了化学键。D是化学变化,符合题意。答案选D。
本题难度:一般
4、选择题 有体积相同的碳酸钠溶液和盐酸。①将碳酸钠溶液逐滴加入盐酸中与②盐酸逐滴加入碳酸钠溶液中产生的气体物质的量之比为2 :1,则原碳酸钠溶液和盐酸中溶质的物质的量之比为
A.2:1
B.1:1
C.3:4
D.1:2
参考答案:C
本题解析:假设①②产生的气体的物质的量分别为2mol、1mol ,因两种操作中盐酸不可能均过量(生成的CO2量不同),故盐酸为不足量。
①将碳酸钠溶液逐滴加入盐酸,由反应Na2CO3+2HCl=2NaCl+H2O+CO2↑知消耗n(HCl)=4mol,
②盐酸逐滴加入碳酸钠中反应分步进行(盐酸完全反应,NaHCO3有剩余),由方程式NaHCO3 + HCl =" NaCl" + H2O + CO2↑,Na2CO3 + HCl = NaHCO3及n(CO2)=1mol可求得n(Na2CO3)=3mol,故此反应中原碳酸钠溶液和盐酸中溶质的物质的量之比为3:4。
本题难度:简单
5、选择题 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).
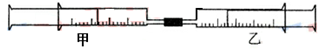
则下列说法正确的是
A.实验1中沉淀最终变为红褐色
B.实验2中甲针筒内的现象是气体颜色变深,且活塞向内移动
C.实验3中甲针筒内气体颜色变深,活塞向内压缩
D.实验4中甲针筒内除有白烟产生外,活塞最终可能向内压缩到尽头
参考答案:C
本题解析:分析:A、氨气与硝酸银溶液反应生成氢氧化银,氢氧化银与氨水反应生成氢氧化二氨合银;
B、发生反应2HBr+Cl2=Br2+2HCl,溴挥发形成蒸汽,甲针筒内的现象是气体颜色变深,气体的物质的量增大;
C、发生反应2NO+O2=2NO2,同时存在2NO2?N2O4,气体的物质的量减小;
D、首先3Cl2+2NH3=N2+6HCl,氨气过量再发生NH3+HCl═NH4Cl,故氨气足量发生3Cl2+8NH3=N2+6NH4Cl,据此计算判断.
解答:A、AgNO3+NH3?H2O═AgOH↓+NH4NO3,AgOH为白色沉淀,氨气过量AgOH+2NH3?H2O═[Ag(NH3)2]OH+2H2O,沉淀消失,故A错误;
B、发生反应2HBr+Cl2=Br2+2HCl,二者恰好反应,溴挥发形成蒸汽,甲针筒内气体颜色变深,气体的物质的量增大,活塞向外移动,故B错误;
C、发生反应2NO+O2=2NO2,同时存在2NO2?N2O4,甲针筒内气体颜色变深,气体的物质的量减小,活塞向内压缩,故A正确;
D、氯气与氨气体积之比为15mL:40mL=3:8,发生反应3Cl2+8NH3=N2+6NH4Cl,生成氮气15mL×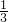 =5mL,有白烟产生外,活塞最终不可能向内压缩到尽,故D错误;
=5mL,有白烟产生外,活塞最终不可能向内压缩到尽,故D错误;
故选C.
点评:本题考查氨气、氯气、氮的氧化物等性质,难度中等,C选项中为易错点,注意存在的平衡.
本题难度:简单