微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是?;
淡黄色固体F中含有的化学键是?。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
??。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
??。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为:? 。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为:??。(用化学式表示)
参考答案:(每空2分,共12分)
(1)第二周期、第IVA族(答不全不得分) ; 离子键、非极性共价键(答不全不得分)
(2)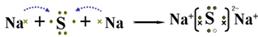
(3)Al(OH)3+ OH- = AlO2-+2H2O
(4)S2—>Cl—>Na+>Al3+
(5)HCl>H2S>SiH4
本题解析:根据Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F,F为Na2O2,Q为O,A为Na。根据A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,B为Al,Z为Cl。根据X元素的最外层电子数比次外层电子数少4,X为Si。根据W与X在同一主族,W为C。根据Y元素的L层电子数等于K、M两个电子层上的电子数之和,Y为S。
(1)W为C,故在周期表中的位置是第二周期、第IVA族。
淡黄色固体F为Na2O2,含有的化学键是离子键、非极性共价键。
(2)A与Y两元素形成化合物为Na2S,电子式表示此化合物的形成过程为 。
。
(3)A、B两元素的最高价氧化物的水化物分别为NaOH,Al(OH)3,反应的离子方程式为Al(OH)3+ OH- = AlO2-+2H2O。
(4)A、B、Y、Z四种元素的简单离子的离子分别为Na+、Al3+、S2—、Cl—,电子层数越多,半径越大;具有相同电子排布的离子,核电核数越大半径越小。故离子半径由大到小的顺序为S2—>Cl—>Na+>Al3+。
(5)X、Y、Z三种元素的氢化物分别为SiH4、H2S、HCl,元素的非金属性越强,对应其氢化物的稳定性越强,故氢化物的稳定性由强到弱的顺序为HCl>H2S>SiH4?。
点评:本题考查原子的符号,电子式,化学方程式的书写,难度不大。
本题难度:一般
2、填空题 (4分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
粒子代号
| A
| B
| C
| D
| E
| F
| G
|
原子核数
| 单核
| 单核
| 双核
| 4核
| 单核
| 多核
| 多核
|
电荷数
| 0
| 1+
| 1—
| 0
| 2+
| 1+
| 0
|
其中,B的离子半径大于E的离子半径;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图?。
(2)比较BC和EC2的碱性强弱BC?EC2(填<?、>?、="?" )。
(3)F与C反应的离子方程式? ?
?
参考答案:
(1)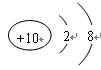 ?(1分)
?(1分)
(2)?>?(1分)
(3)NH4+ +OH― =NH3.H2O?或? NH4+ +OH―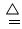 NH3↑ ?+ H2O?(2分)
NH3↑ ?+ H2O?(2分)
本题解析:略
本题难度:简单
3、选择题 下列有关说法错误的是?
A.P、S、Cl元素的最高化合价依次升高
B.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型
C.Na、K、Rb第一电离能逐渐增大
D.N、O、F电负性依次增大
参考答案:C
本题解析:C.Na、K、Rb第一电离能逐渐减小,同主族从上往下,第一电离能逐渐减小;?
点评:考查元素的第一电离能和电负性;杂化轨道理论;
本题难度:简单
4、选择题 下列说法正确的是
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
参考答案:C
本题解析:同周期自左向右,原子半径逐渐减小,非金属性逐渐增强,则选项AB都是错误的。同主族自上而下金属性逐渐增强,非金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐增强,但非金属元素氢化物的稳定性逐渐降低,所以选项C正确,D错误,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题侧重对基础性知识的巩固与检验,有利于培养学生灵活运用元素周期律解决实际问题的能力,提高学生的应试能力。
本题难度:一般
5、填空题 已知:X、Y、Z、R四种短周期元素原子序数依次增大,X的气态氢化物水溶液呈碱性,Y原子的L层电子数是K层电子数的3倍,Z和R的单质在一定条件下与铜反应生成Cu2Z和CuR2,请根据要求填空。
(1)画出X的原子结构示意图?。R最高价氧化物对应水化物的化学式为?。
(2)Y、Z、R三种元素中原子半径最大的是?(用元素符号表示)。
(3)X气态氢化物与Z的最高价氧化物对应水化物反应生成的产物中所含化学键的类型为?;检验该产物中阳离子的实验方法是?。
(4)R的单质通入到澄清石灰水中反应的离子方程式为?。
参考答案:(1)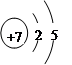 ?;HClO4?(2)S。?(3)离子键、共价键、配位键;
?;HClO4?(2)S。?(3)离子键、共价键、配位键;
取少量产物于试管中,加入浓的氢氧化钠溶液,将粘有湿润的红色石蕊试纸的玻璃棒放在试管口部(或将蘸有浓盐酸的玻璃棒放在试管口部),加热,若试纸变蓝(或若有白烟生成),则证明产物中含有NH4+。
(4)Cl2+2OH-=Cl-+ClO-+H2O。
本题解析:。(1)X是短周期元素X的气态氢化物水溶液呈碱性,则X是N元素。Y原子的L层电子数是K层电子数的3倍,Y是O元素。Z和R的单质在一定条件下与铜反应生成Cu2Z和CuR2,则Z是元素,R是Cl元素。Cl元素最高价氧化物对应水化物是高氯酸,它的的化学式为HClO4。2)氮元素是第二周期的元素,硫、氯是第三周期的元素。对于不同周期的元素来说,原子核外电子层数越多,原子半径越大。对于电子层数相同的元素来说,原子序数越大,原子半径越小。所以三者半径最大的是硫元素。(3)X气态氢化物是NH3与Z的最高价氧化物对应水化物是HClO4。反应生成的产物NH4ClO4。中所含化学键有离子键、共价键、配位键;检验NH4+方法向待检验溶液中加入浓的氢氧化钠溶液,并加热,若产生能使紫色石蕊试液变蓝的气体就证明含有铵根离子。或者将粘有湿润的红色石蕊试纸的玻璃棒放在试管口部(或将蘸有浓盐酸的玻璃棒放在试管口部),加热,若试纸变蓝(或若有白烟生成),则证明产物中含有NH4(4)Cl2与氢氧化钙溶液发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
本题难度:一般