微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。

(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是?(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为?(选填下列仪器编号,固定装置省略)。
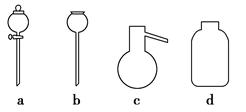
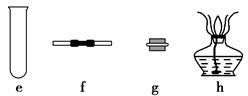
(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①?;
②?。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是?;
②写出C中发生反应的化学方程式:?;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有?。
参考答案:(1)②或③ e、f、g、h
(2)①在装置C与D之间增加一个防倒吸装置
②在D后增加一个尾气吸收装置
(3)①吸收CO2和水蒸气,并生成O2
②4NH3+5O2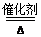 4NO+6H2O
4NO+6H2O
③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色
本题解析:解答本题要注意以下两点:(1)题目对制取氨气的药品有限制条件。(2)根据实验的药品特点选择仪器和分析装置的作用及实验现象。
本题难度:一般
2、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为(? )
A.2mol
B.1 mol
C.0.5mol
D.0.25mol
参考答案:D
本题解析:根据得失电子数相等,生成1 mol硝酸锌时,锌失去2mol电子,设有Xmol硝酸被还原,N元素由+5价降到—3价,8X=2?解得X=0.25mol,故选D
本题难度:一般
3、实验题 (14分)下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
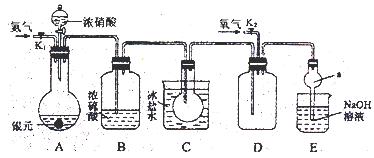
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是?。
(2)若装置中缺B,其后果是?。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是?。
(4)C装置的作用是?;E中a仪器所起的作用是?。
(5)已知该银圆的质量为25g,加入75mL 12mol·L—1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2mol·L—1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL。
①参加反应的硝酸的物质的量是?。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是?。
参考答案:(1)赶走装置中的空气,防止干扰实验。
(2)无法确认铜与硝酸反应是否生成了NO气体
(3)热的空气使平衡 2NO2? ?N2O4向逆方向移动,导致颜色加深
?N2O4向逆方向移动,导致颜色加深
(4)将NO2 和NO分开(或除去二氧化氮气体)?防倒吸
(5) 0、75mol?向反应后的溶液中加入足量的盐酸,过滤洗涤称量干燥沉淀的质量
本题解析:(1)由于装置中含有空气,而空气能把NO氧化生成NO2,从而干扰实验的检验,所以这样操作的目的是赶走装置中的空气,防止干扰实验。
(2)由于生成的气体中 含有水蒸气,而NO2能和水反应生成NO,从而无法确认铜与硝酸反应是否生成了NO气体,所以不能缺少B装置。
(3)由于存在可逆反应2NO2 N2O4,由于该反应是放热反应,所以热的空气可以使平衡 2NO2
N2O4,由于该反应是放热反应,所以热的空气可以使平衡 2NO2 N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深。
N2O4向逆方向移动,因此NO2浓度增大,从而导致颜色加深。
(4)由于在低于0℃时,几乎只有无色的N2O4的晶体存在,所以C装置的目的是通过降温将NO2 和NO分开(或除去二氧化氮气体)。由于NO2极易被氢氧化钠溶液吸收,如果直接插入会导致溶液的倒流,所以E中a仪器所起的作用是防倒吸。
(5)①硝酸的总的物质的量是0.9mol,剩余硝酸是0.15mol,所以参加反应的硝酸是0.9mol-0.15mol=0.75mol。
②由于反应后金属生成了硝酸盐,所以要测定该银圆中铜的质量分数,还需要把金属阳离子变成沉淀,然后通过称量即可计算,所以正确的操作可以是向反应后的溶液中加入足量的盐酸,过滤、洗涤、干燥、称量沉淀的质量。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。化学实验主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求学生必须认真审题,通过联系所学过的知识和技能,灵活运用并进行知识的类比、迁移、重组,全面细致的思考才能作出正确的解答。
本题难度:一般
4、填空题 (16分)有分别含有A、B、C、D、E、F的六瓶无色溶液,这六种溶质均是中学化学中常用的无机试剂。已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同。现进行如下实验:
①A的溶液有刺激 性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,请回答下列问题:
(1)确定化学式A??C?.? E?
(2)写出F中沉淀完全溶解的化学方程式?。
(3)B在溶液中电离出的阴离子为?(填化学式),能否确定B在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。?。
(4)D在溶液中电离出的阴离子为?(填化学式),能否确定D在溶液中电离生产的阳离子?若能,写出离子符号,若不能说明进一步鉴定的方法。?。
参考答案:(1)? NH3? BaCl2? H2SO4
(2)AgOH+2NH3·H2O=" Ag" (NH3)2OH+2H2O
(3)CO32--?用洁净的铂丝蘸取少量B的溶液,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
(4)SO42?-取少量D的溶液,向其中滴加NaOH溶液有沉淀 生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
本题解析:略
本题难度:困难
5、计算题 有100 mL混合气体,可能由NH3、HCl、CO2和NO组成,把混合气体通过浓H2SO4,气体体积减少30 mL,再经过Na2O2,气体又减少30 mL,最后经过水,剩余气体为20 mL(均在同温同压下测定,且不考虑水蒸气体积)。问:
(1)该混合气体由哪些气体混合而成?各占多少毫升?
(2)最后剩余20 mL是什么气体?简要说明理由。
参考答案:(1)混合气体由NH3、CO2、NO组成,其中V(NH3)="30" mL,
V(CO2)="30" mL,V(NO)="40" mL。
(2)最后剩余的20 mL气体为NO。
本题解析:混合气体通过浓H2SO4,体积减少30 mL,即V(NH3)="30" mL,由NH3的存在知不可能有HCl气体,则剩余气体为CO2和NO体积为100 mL-30 mL="70" mL
设CO2体积为x,则NO为(70 mL-x),
由反应方程式:2CO2+2Na2O2====2Na2CO3+O2可知生成的O2体积为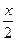 。
。
①若氧气过量
2NO? +? O2? ="===?" 2NO2
2? 1? 2
70 mL-x?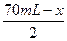 ?70 mL-x
?70 mL-x
所以有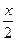 -
-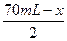 +70 mL="40" mL
+70 mL="40" mL
解之,不合理。
②若NO过量,依题意有
2NO+O2====2NO2
2? 1? 2
x?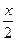 ?x
?x
(70 mL-x)-x+x="40" mL
所以x="30" mL
即V(CO2)="30" mL
V(NO)="70" mL-30 mL="40" mL
由上可知NO过量了10 mL,生成了30 mL NO2,经过水后,最后剩余的20 mL气体为NO,因为由
3NO2+H2O====2HNO3+NO
30? 10
生成了10 mL NO,加上过量的10 mL,共20 mL NO。
本题难度:简单