微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在元素周期表中,位于第二周期第ⅥA族的元素是( )
A.C
B.N
C.O
D.F
参考答案:位于第二周期第ⅥA族的元素,其原子结构中有2个电子层,最外层电子数为6,第一电子层电子数为2,则质子数为2+6=8,所以该元素为氧元素,元素符号为O,
故选C.
本题解析:
本题难度:一般
2、选择题 已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是
A.铍的原子半径小于硼的原子半径
B.铍与等浓度盐酸的反应比镁剧烈
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍能与冷水反应产生氢气
参考答案:C
本题解析:同一周期,从左到右,原子半径逐渐减小,所以铍的原子半径大于硼的原子半径;同一主族,从上到下,金属性逐渐增强,即金属性铍<镁<钙,以镁的性质推断铍、钙的性质,则B、D项均不正确,C项正确.
本题难度:困难
3、选择题 下列说法正确的是( )
A.P和S属于第三周期元素,P原子半径比S小
B.Na和Rb属于第IA族元素,Rb失电子能力比Na强
C.C和si属于第IVA族元素,SiH4比CH4稳定
D.Cl和Br属于第VIIA族元素,HClO4酸性比HBrO4弱
参考答案:A、P和S属于第三周期元素,核电荷数P<S,所以原子半径P>S,故A错误;
B、Na和Rb属于第IA族元素,原子半径Na<Rb,Rb失电子能力比Na强,故B正确;
C、C和si属于第IVA族元素,非金属性C>si,所以CH4比SiH4稳定,故C错误;
D、Cl和Br属于第VIIA族元素,非金属性Cl>Br,HClO4酸性比HBrO4强,故D错误.
故选:B.
本题解析:
本题难度:简单
4、简答题 某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色纸条.
已知常温下浓盐酸与高锰酸钾能反应生成氯气.
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液.
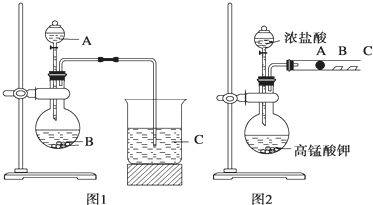
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质:A______,B______.(填化学式)
②烧杯C中发生反应的离子方程式为______.
(2)乙同学实验中(图2):
①写出A处反应的离子方程式______.
②B处实验现象是______.
③若高锰酸钾的还原产物为Mn2+,当有0.04mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______L.
参考答案:(1)①验证元素非金属性与对应最高价含氧酸之间的关系,所选取的酸应为稀硝酸,圆底烧瓶内的固体药品应为大理石,不能用碳酸钠粉末,反应剧烈,不易控制反应,C中应盛装硅酸钠溶液,以此来证明硝酸、碳酸以及硅酸的酸性强弱,故答案为:HNO3;CaCO3;
②C中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,
反应的离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,故答案为:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
(2)单质的氧化性Cl2>Br2>I2,则
①氯气通入溴化钠溶液中发生置换反应生成溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
②氯气和KI溶液反应生成单质碘,淀粉变蓝,故答案为:试纸变蓝;
③根据电子守恒可得关系式:2KMnO4~5Cl2,当有0.04mol高锰酸钾参加反应时,生成n(Cl2)=0.04mol×52=0.1mol,
则V(Cl2)=0.1mol×22.4L/mol=2.24L,
故答案为:2.24.
本题解析:
本题难度:一般
5、选择题 已知短周期元素(1~18号元素)的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D
B.原子序数:d>c>b>a
C.单质的还原性:A>B>D>C
D.离子半径:C>D>B>A
参考答案:D
本题解析:试题分析:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c.
A、A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B、aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,所以原子序数:a>b>d>c,故B错误.
C、aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以单质的还原性:B>A,故C错误;
D、aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C>D>B>A,故D正确;
故选D。
考点:原子结构与元素周期率的关系
点评:本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大。
本题难度:一般