微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 几种短周期元素的原子半径及主要化合价如下表:
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
参考答案:C
本题解析:试题分析:X是短周期中最活泼的金属,且与R同周期,因此X是Na。R的最高价是+3价,则R是Al。Y和M的化合价都有-2价,应为周期表第ⅥA族元素,Y的最高价为+6价,应为S元素,M无正价,应为O元素;Z的化合价为+5、-3价,应为周期表第ⅤA族,原子半径小于硫元素原子半径而大于氧元素原子半径,故处于第二周期,为N元素。A、电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Al3+,故A正确;B、Z与M组成的化合物是NO或NO2,均是形成硝酸型酸雨的原因之一,故B正确;C、SO2溶于水显酸性,因此将SO2通入BaCl2溶液中,不能反应生成亚硫酸钡白色沉淀,故C错误;D、氢氧化铝属于两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水,故D正确,答案选C。
考点:考查元素周期表的结构以及元素周期律的应用
本题难度:简单
2、填空题 实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置:
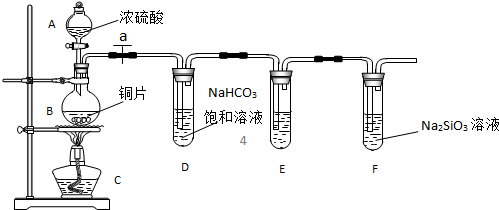
填写所示仪器名称A______B______
(2)实验步骤:
连接仪器、______、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是______;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性______(填“能”或“否”),试管D中发生反应的离子方程式是______.
参考答案:(1)根据装置图中的仪器可知A为分液漏斗,B为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)△. CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
故答案为:Cu+2H2SO4(浓)△. CuSO4+SO2↑+2H2O;除去SO2气体;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱,试管D中发生反应是二氧化硫与碳酸氢钠生成二氧化碳,其离子方程式为:SO2+2HCO3-=SO32-+H2O+2CO2,
故答案为:否;SO2+2HCO3-=SO32-+H2O+2CO2.
本题解析:
本题难度:一般
3、选择题 下列叙述不正确的是
A.原子半径:H < Al < Mg < Na
B.热稳定性:HCl > H2S > PH3 > AsH3
C.N、O、F元素的非金属性依次减弱
D.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
参考答案:C
本题解析:本题只需熟悉元素周期律相关规律即可。
本题难度:一般
4、选择题 已知同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性顺序是HXO4>H2YO4>H3ZO4下列判断正确的是( )
A.单质的氧化性按照X、Y、Z的顺序逐渐增强
B.单质与H2化合的能力按照X、Y、Z的顺序依次增强
C.气态氢化物的稳定性按照X、Y、Z的顺序逐渐减弱
D.阴离子的还原性按照X、Y、Z的顺序逐渐减弱
参考答案:由同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性顺序是HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A、非金属性越强,单质的氧化性越强,则单质的氧化性按照X、Y、Z的顺序逐渐减弱,故A错误;
B、非金属性越强,越易与氢气化合,则质与H2化合的能力按照X、Y、Z的顺序依次减弱,故B错误;
C、非金属性越强,气态氢化物越稳定,则态氢化物的稳定性按照X、Y、Z的顺序逐渐减弱,故C正确;
D、非金属性越强,对应阴离子的还原性越弱,则阴离子的还原性按照X、Y、Z的顺序逐渐增强,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 甲、乙两种非金属:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙阴离子发生氧化还原反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.能说明甲比乙的非金属性强的是( )
A.①②③④
B.①②③
C.①②③④⑤
D.②③④⑤
参考答案:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强,则甲的非金属性比乙强,故①正确;
②甲比乙更容易与氢气化合,则甲的非金属性比乙强,故②正确;
③甲单质能与乙阴离子发生氧化还原反应,则甲的非金属性比乙强,故③正确;
④与金属反应时,甲原子得电子数目比乙的多,但得电子不一定容易,则不能说明甲比乙的非金属性强,故④错误;
⑤甲的单质熔沸点比乙的低,来源:91考试网 91ExAm.org无法确定非金属的关系,故⑤错误;
显然①②③能说明甲比乙的非金属性强,
故选B.
本题解析:
本题难度:一般