微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有下列四种物质:①NH4Cl、②Cl2、③FeCl3、④NO.其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是______(填序号,下同),遇到KSCN溶液能变红的是______,易与空气中氧气反应的是______,通常状况下呈黄绿色的是______.
参考答案:NH4Cl与碱反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝;FeCl3溶液遇KSCN溶液变为红色;NO能与空气中氧气反应生成NO2;通常状况下Cl2呈黄绿色;
故选:①;③;④;②;
本题解析:
本题难度:一般
2、简答题 氯化铁能腐蚀铜(2FeCl3+Cu=2FeCl2+CuCl2),工业上常用此原理生产印刷线路板(步骤Ⅰ).从废液中回收铜并得到FeCl3溶液循环利用的主要流程如下:
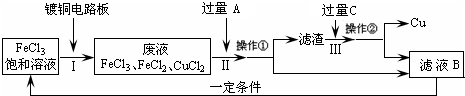
(1)写出步骤Ⅱ中发生反应的离子方程式______.
(2)试剂C是(填名称)______.
(3)若在实验室中完成上述流程,操作①中属于______操作(填名称).
(4)在步骤Ⅲ中加入过量C溶液的目的是______.
参考答案:(1)步骤Ⅱ是加入过量铁和氯化铁、氯化铜反应,最终得到氯化亚铁溶液、铁和铜,发生的反应的离子方程式为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸,故答案为:盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离,故答案为:过滤;
(4)在步骤Ⅲ中加入过量C溶液的目的是溶解滤渣中的铁生成氯化亚铁溶液,循环使用,故答案为:溶解滤渣中的铁生成氯化亚铁溶液,循环使用.
本题解析:
本题难度:一般
3、选择题 将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100mL物质的量浓度为2.2mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL).向滤液中加入2mol/L?NaOH溶液至40mL时开始出现沉淀.则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为( )
A.1.8?mol/L
B.2?mol/L
C.2.2?mol/L
D.无法计算
参考答案:A
本题解析:
本题难度:一般
4、填空题 氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:
C6H12O6+6O2 = 6CO2+6H2O+能量,该反应中的还原剂是_____________。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有____________。 (填“氧化性”或“还原性”)
(3)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作 “腐蚀剂”刻制印刷电路,写出离子方程式___________________________。
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_____________。如果药片已经失效,应如何检验?写出主要操作与现象:___________________________。
参考答案:(1)C6H12O6
(2)还原性
(3)2Fe3++Cu=2Fe2++ Cu2+
(4)保护FeSO4不被空气中的氧气氧化;取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效
本题解析:
本题难度:一般
5、简答题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
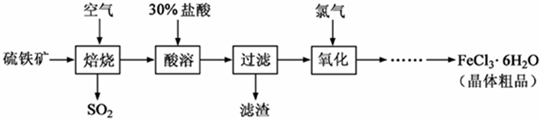
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2?
2SO3,该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应的化学方程式为______.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______、______.
(3)通氯气氧化后时,发生的主要反应的离子方程式为______;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为______(写化学式).
参考答案:(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2催化剂.△2SO3,该反应的平衡常数表达式为K=c2(SO3)c(O2)c2(SO2);过量的SO2与NaOH溶液反应的化学方程式为:SO2+NaOH=NaHSO3;
故答案为:c2(SO3)c(O2)c2(SO2);SO2+NaOH=NaHSO3;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是抑制铁离子的水解,使更多的铁元素转化为氯化亚铁;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)通氯气氧化后时,氯气氧化亚铁离子为铁离子,发生的主要反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为过量的氯气和盐酸溶液中挥发出的氯化氢气体;
故答案为:Cl2 HCl;
本题解析:
本题难度:一般