| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应与能量》试题巩固(2017年最新版)(四)
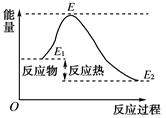 参考答案:B 本题解析: 本题难度:一般 2、选择题 对于化学反应:2Na+2H2O |
参考答案:C
本题解析:A、该反应中既有旧化学键的断裂,也有新化学键的形成,A正确;B、该反应中每消耗1 mol Na,则同时消耗18 g H2O,产生1 mol NaOH和11.2 L H2(标准状况下),B正确;C、常温下能自动进行的反应不一定是放热反应,C错误;D、由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少,D正确;答案选C。
考点:反应热
本题难度:一般
3、选择题 下列说法正确的是(?)
A.原子间的相互作用叫做化学键
B.阴、阳离子间通过静电吸引形成的化学键是离子键
C.AlCl3中含有共价键,NH4Cl属于离子化合物
D.物质中都含有化学键
参考答案:C
本题解析:A、使离子相结合或原子相结合的作用力通称为化学键,故错;B、阴、阳离子间通过静电作用形成的化学键是离子键,故错;D、稀有气体分子中不含化学键,故错。故选C。
点评:本题考查的是化学键的相关知识,题目难度不大,熟悉化学键的构成原理是解题的关键。
本题难度:一般
4、选择题 将Ba(OH)2·8H2O晶体与NH4Cl晶体混合,能表示反应过程中能量变化的示意图是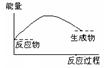
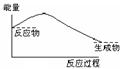
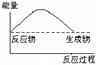

A B C D
参考答案:A
本题解析:略
本题难度:一般
5、选择题 下列离子方程式正确的是
A.双氧水与酸性KMnO4混合:MnO4-+2H2O2+3H+→Mn2++3O2↑+2H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O→Fe(OH)2+2HClO
C.将1mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相混合均匀:3AlO2+9H+→Al(OH)3+2Al3++3H2O
D.双氧水从酸化海带液中提取碘:2I-+H2O2+2H+→I2+2H2O
参考答案:CD
本题解析:分析:A、离子方程式中电子不守恒;
B、次氯酸具有强氧化性能氧化亚铁离子;
C、依据偏铝酸根离子和氢离子反应生成氢氧化铝沉淀,过量氢离子溶解氢氧化铝的性质结合定量关系写出;
D、过氧化氢酸性溶液中氧化碘离子为单质碘;
解答:A、双氧水与酸性KMnO4混合反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故A错误;
B、次氯酸具有强氧化性能氧化亚铁离子?2Fe2++5ClO-+5H2O=2Fe(OH)3↓+4HClO+Cl-,;
C、将1mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相混合均匀偏铝酸根离子和氢离子反应生成氢氧化铝沉淀,过量氢离子溶解氢氧化铝的性质结合定量关系写出:3AlO2-+9H+=Al(OH)3+2Al3++3H2O,故C正确;
D、过氧化氢酸性溶液中氧化碘离子为单质碘,双氧水从酸化海带液中提取碘:2I-+H2O2+2H+=I2+2H2O,故D正确;
故选CD.
点评:本题考查了离子方程式书写方法和注意问题,注意氧化还原反应的存在和电子守恒的分析判断,题目难度中等.
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《铁盐》考点.. | |