微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某蓄电池充放电时的反应如下:

有下列推断,其中正确的是:①放电时铁极为正极,Ni2O3为负极 ②充电时阴极上的电极反应式是Fe(OH)2+2e=Fe+2OH-?③充电时,Ni(OH)2为阳极?④蓄电池的电极必须浸在某种碱性电解质溶液中
A.②③④
B.①③④
C.①②④
D.①②③
参考答案:A
本题解析:各种蓄电池及可充电电池都是可逆电池,放电时发生原电池反应,充电时发生电解反应,方程式左、右互为反应物和生成物。
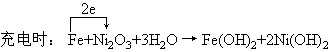
Fe为负极:Fe-2e+2H2O=Fe(OH)2+2H+
正极反应:Ni2O3+2e+3H2O=2Ni(OH)2+2OH-
两电极反应的加合,即为电池反应。
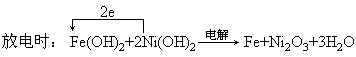
阳极(氧化):2Ni(OH)2-2e+2OH-=Ni2O3+3H2O
阴极(还原):Fe(OH)2+2e=Fe+2OH-
两式相加即为电解(充电)总反应。由以上两种过程可以看出,反应是在碱性环境中进行的。故正确的推断为A。
本题难度:一般
2、填空题 设计实验实现下列过程.
解题要求:画出装置图,指明装置中的各物质名称
(1)Cu+2AgNO3=2Ag+Cu(NO3)2?(2)2Ag+Cu(NO3)2=Cu+2AgNO3.
参考答案:(1)Cu+2AgNO3=2Ag+Cu(NO3)2,该反应中铜作还原剂,失电子变成铜离子进入溶液,发生氧化反应;不如负极活泼的金属或导电的非金属作正极,根据反应方程式可选银作正极,正极上银离子得电子生成银单质,发生还原反应;氧化剂溶液作电解质溶液,所以选硝酸银溶液作电解质溶液.
故答案为:
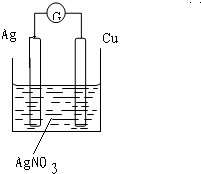
;
(2)2Ag+Cu(NO3)2=Cu+2AgNO3,该反应中铜比银活泼,但银置换出铜,所以不能设计成原电池,只能设计成电池.
该反应中银作还原剂,还原剂作阳极,所以铜作阳极;氧化产物金属单质作阴极,所以铜作阴极;氧化剂溶液作电解质溶液,该反应中硝酸铜作氧化剂,所以电解质溶液是硝酸铜溶液.
故答案为:
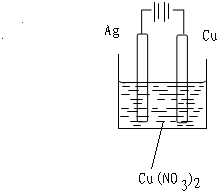
.
本题解析:
本题难度:简单
3、选择题 某原电池反应的离子方程式为:Fe+2H+=Fe2++H2↑,则下列说法正确的是(?)
A.HNO3为电解质溶液
B.锌为原电池正极
C.铁极质量不变
D.铜为原电池正极
参考答案:D
本题解析:由电池反应的离子方程式知,负极为铁,则正极应是比铁不活泼的金属,B选项错。在反应中负极不断被消耗,C选项错。由于反应放出了氢气并生成了Fe2+,故知电解质溶液不能是HNO3。由上分析可知正确选项为D。
本题难度:一般
4、选择题 下列关于原电池的叙述中,正确的是
A.构成原电池的两极必须是两种不同的金属
B.原电池中发生的反应一定是氧化还原反应
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原、
参考答案:B
本题解析:试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知选项B正确。A不正确,也可以是金属与非金属;C不正确,例如燃料电池中负极不溶解;D不正确,原电池的正极不一定参与反应,溶液中的阳离子不一定在此被还原,答案选B。
考点:考查原电池原理的有关判断
点评:该题是中等难度的试题,试题设计新颖,有助于调动学生的学习兴趣,激发学生学习化学的积极性。该题基础性强,侧重对学生基础知识的巩固与训练。该题的关键是明确原电池的工作原理,然后灵活运用即可。
本题难度:一般
5、填空题 10分)下图是一个化学过程的示意图

回答下列问题:
(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,
乙装置中B(Ag)的电极反应式为 ,
丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体,若要使丙池恢复电解前的状态,
应向丙池中 (写化学式)。
参考答案:(1)原电池 ,阳极 ;(2)CH4+10OH--8e-=CO32-+7H2O , Ag++e-=Ag , H2和NaOH;(3)通入HCl。
本题解析:(1)甲池左端充入甲烷、右端充入氧气构成燃料电池,则甲池是原电池,乙池、丙池是电解池,根据原电池工作原理:通入甲烷的一极是负极,则通入氧气的一极是正极,A连接原电池的正极,A是阳极,则B是阴极,C是阳极,D是阴极;(2)燃料电池相当于燃料燃烧,CH4是负极,溶液是碱性溶液,生成CO2转变成CO32-,电极反应式:CH4-8e-+10OH-=CO32-+7H2O,乙装置中的B连接原电池的负极,B是阴极,阳离子在此放电,阳离子有Ag+、H+,根据电解池工作原理:Ag+先放电,Ag++e-=Ag,丙装置是电解池,电解饱和食盐水,总电极反应式:2Cl-+2H2O Cl2↑+H2↑+2OH-,D作阴极,阳离子在此放电,阳离子有水电离出的H+、Na+,根据电解池的工作原理:H+先放电,反应式:2H2O+2e-=H2↑+2OH-,则产物是H2和NaOH;(3)当丙池中产生112mL(标准状况下)气体是H2、Cl2,因此恢复到电解前的状态,应向丙池中加入HCl。
Cl2↑+H2↑+2OH-,D作阴极,阳离子在此放电,阳离子有水电离出的H+、Na+,根据电解池的工作原理:H+先放电,反应式:2H2O+2e-=H2↑+2OH-,则产物是H2和NaOH;(3)当丙池中产生112mL(标准状况下)气体是H2、Cl2,因此恢复到电解前的状态,应向丙池中加入HCl。
考点:考查原电池工作原理、电解池工作原理等知识。
本题难度:困难