微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是
A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4↓+Al(OH)3↓
C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl–
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+
参考答案:C
本题解析:A、澄清石灰水少量时表现在离子方程式中,OH-应无剩余,而所给离子方程式中Ca2+与OH-的个数比为1:1,化学式中为1:2,所以方程式表达的是石灰水过量,与已知不符,错误;B、明矾的化学式中Al3+与SO42–的个数比为1:2,而该方程式中为1:1,说明SO42–没沉淀完全,错误;C、FeBr2的物质的量为0.4mol,氯气的物质的量为0.5mol,氯气先与Fe2+反应用掉0.2mol,余下的0.3mol与Br–反应,氯气不足,Br–只用掉0.6mol,所以Fe2+、Cl2、Br–的物质的量之比为0.4:0.5:0.6=4:5:6,正确;D、强碱性溶液中,反应后的溶液不会显酸性至大呈中性,错误,答案选C。
本题难度:简单
2、选择题 下列离子方程式的书写正确的是
A.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
B.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O
C.高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
D.Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O
参考答案:C
本题解析:略
本题难度:一般
3、选择题 将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是( )
A.
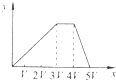
B.
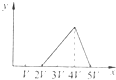
C.
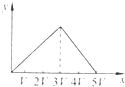
D.
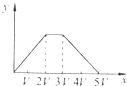
参考答案:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol.
关键弄清楚反应顺序,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,沉淀增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,达最大值.
然后发生反应NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1.
A、由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象A符合,故A正确;
B、离子反应的顺序错误,图为先与铵根离子反应,不符合反应过程,故B错误;
C、未画出铵根离子的反应、生成氢氧化铝沉淀与氢氧化铝溶解消耗的氢氧化钠得到物质的量不符合,故C错误;
D、三阶段消耗NaOH溶液的体积比为3:1:1,图中比例不符合,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 下列化学反应的离子方程式正确的是?(?)
A.金属铝溶于氢氧化钠溶液:2Al+6OH-
B.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-
C.二氧化硅与足量烧碱溶液反应:SiO2+2OH-
D.硫酸滴加到氢氧化钡溶液中:H++OH-
参考答案:C
本题解析:略
本题难度:简单
5、简答题 (1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:
①盐碱地产生碱性的原因______
②用石膏降低其碱性的原理______
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol.
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:______.
(3)常温下,等物质的量的浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(N
)由大到小的顺序为______>______>______>______>______?(填序号).
参考答案:(1)①碳酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
②石膏能与碳酸根离子反应,降低碱性,离子反应为CO32-+CaSO4═SO42-+CaCO3,
故答案为:CO32-+CaSO4═SO42-+CaCO3;
(2)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol,
由盖斯定律可知①×3+②得Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)
△H=(-218kJ/mol)×3+640.5kJ/mol=-13.5kJ/mol,
故答案为:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5kJ/mol;
(3)假设浓度均为1mol/L,④⑤接近2mol/L,但④中离子相互促进水解,则⑤>④;②③接近1mol/L,但②中氢离子抑制铵根离子水解,则②>③;氨水中一水合氨电离产生铵根离子,则浓度最小,所以铵根离子浓度为⑤>④>②>③>①,故答案为:⑤;④;②;③;①.
本题解析:
本题难度:一般