| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《影响化学反应速率的因素》高频试题特训(2017年最新版)(二)
参考答案:B 本题解析:温度越高,反应速率越快,故A错误;500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl,H+浓度不变,反应速率不变,故B正确;1 mol/L的H2SO4代替1 mol/L的HCl,H+浓度增大,反应速率加快,故B错误;锌粉代替锌粒,增大反应物接触面积,反应速率加快,故D错误。 本题难度:一般 2、选择题 一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 |
参考答案:B
本题解析:①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确,所以答案为B。
考点:本题考查化学反应速率的影响因素。
本题难度:一般
3、选择题 在下列过程中,需要加快反应速率的是( )
A.钢铁腐蚀
B.橡胶老化
C.食品腐烂
D.工业炼钢
参考答案:为减少资源的浪费,则钢铁腐蚀、橡胶老化以及食品腐烂应减小反应速率,工业炼钢,为增加产量,应提高反应速率,
故选D.
本题解析:
本题难度:简单
4、简答题 下列图象在t1时所对应的反应条件改变可能为: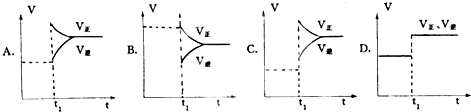
(1)升高温度______?(2)使用催化剂______?(3)增大反应物浓度______?(4)减少生成?物浓度______.
参考答案:(1)升高温度,瞬间V正、V逆都增大,若正反应为放热反应,V正增大较少、V逆增大较多,V正<V逆,平衡向逆反应移动,若正反应为吸热反应反应,V正增大较多、V逆增大较少,V正>V逆,平衡向正反应移动,图象C符合V正增大较多、V逆增大较少,V正>V逆,平衡向正反应移动,正反应为吸热反应,
故答案为:C;
(2)使用催化剂,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,图象D符合,注意若反应前后气体的物质的量不变的反应,增大压强图象也符合,故答案为:D;
(3)增大反应物浓度,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,图象A符合,故答案为:A;
(4)减少反应物浓度,瞬间V正不变,V逆降低,V正>V逆,平衡向正反应移动,图象B符合,故答案为:B.
本题解析:
本题难度:一般
5、选择题 工业制硫酸中的一步重要反应是SO2在℃下的催化氧化: ,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是
,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是
[? ]
A.使用催化剂是为了加快反应速率
B.SO2不可能100%地转化为SO3
C.增加O2的浓度可提高SO2的转化率
D.平衡时SO2的浓度与SO3的浓度相等
参考答案:D
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《与量有关的.. | |