微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
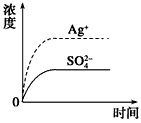
[? ]
A. 
B. 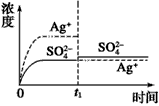
C. 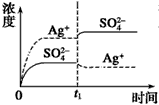
D. 
参考答案:B
本题解析:
本题难度:一般
2、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
3、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
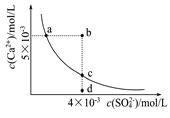
A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:B
本题解析:
考查Ksp。Ksp是一个常数,只跟温度有关,温度不变溶度积常数不变。a、c恰好为平衡点,d为不饱和溶液;b为过饱和溶液,将有晶体析出;
B.a点对应的Ksp等于c点对应的Ksp
本题难度:简单
4、选择题 下列说法正确的是
A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀。是因为溶液中c(Zn2+)·c(S2-)>Ksp(ZnS)
C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小
D.AgCl在10mL 0.05mol·L-1的KCl溶液中比在20mL0.01mol·L-1的AgNO3溶液中溶解的质量少
参考答案:D
本题解析:因为氯化银和铬酸银的阴阳离子个数比不同,所以不能直接根据溶度积常数大小来比较溶解度大小。因为ZnS能溶于盐酸中,如果发生反应生成ZnS的同时,必然有盐酸生成,所以是不可能的。沉淀能否转化,关键是溶液中的离子积是否大于溶度积常数,C是错误的。氯化钾溶液中氯离子浓度大于硝酸银溶液中银离子的浓度,所以溶解的氯化银少,即D是正确的,答案选D。
本题难度:一般
5、填空题 (12分)纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
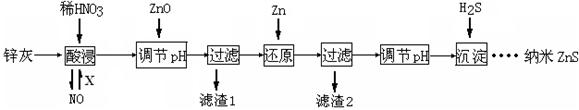
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
参考答案:(1)3FeO+10H++NO3—=3Fe3++NO+5H2O (2分)
(2)空气(或O2) (2分)
(3)除去溶液中的Fe3+ (2分)
(4)Cu、Zn (2分)
(5)1.6×10—22 (2分)
(6)取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。 (2分)
本题解析:(1)HNO3把FeO氧化为Fe3+,HNO3被还原为NO,配平可得离子方程式:3FeO+10H++NO3—=3Fe3++NO+5H2O
(2)NO与O2、H2O反应可生成HNO3,实现尾气循环利用,所以X气体为空气(或O2)。
(3)加入硝酸后,与Fe2O3、FeO反应生成Fe3+,流程中加入ZnO调pH可使Fe3+转化为Fe(OH)3沉淀,所以加入ZnO调pH的目的是除去溶液中的Fe3+
(4)加入Zn后,Zn与Cu2+反应生成Cu,所以滤渣2中的成分是Cu、Zn
(5)c(S2?)= Ksp÷c(Zn2+)=1.6×10-24÷0.01=1.6×10—22mol?L?1,所以溶液中S2—浓度大于1.6×10—22mol?L?1,才生成ZnS沉淀。
(6)纳米级颗粒与水混合可形成胶体,具有丁达尔效应,所以实验方案为:取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。
考点:本题考查化学流程的分析、离子方程式的书写、除杂、胶体的性质、Ksp的计算。
本题难度:一般