微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是
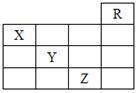
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐;② Z的单质常温下是液体,可与铁粉反应;③ Z的原子序数比Y大19;④Z所在的周期中含有32种元素。
A.①②③④
B.①②③
C.只有①④
D.只有③
参考答案:B
本题解析:考查元素周期表的结构。根据元素在周期表中的位置可知X是N、Y是S、Z是Br、R是He。氨气和硫酸反应生成硫酸铵,①正确。单质溴在常温下是液体和铁反应生成溴化铁,②正确。Br的原子序数是35,S的原子序数是16,二者相差19,③正确。Br是第四周期元素,该周期含有18种元素。所以正确的答案是B。
本题难度:困难
2、选择题 下列离子方程式正确的是
A.NaHCO3溶液水解:HCO3-+H2O?H3O++CO32-
B.NH4HSO3溶液与少量的NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.Ca(ClO)2溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3+2HClO
D.向硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀物质的量最多3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓
参考答案:D
本题解析:分析:A.水解应呈碱性;
B.与少量的NaOH溶液反应,应生成SO32-;
C.应生成CaSO4;
D.向硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀物质的量最多,应为Al3+全部转化为Al(OH)3沉淀.
解答:A.水解应呈碱性,应为HCO3-+H2O?OH-+H2CO3,故A错误;
B.与少量的NaOH溶液反应,应生成SO32-,为HSO3-+OH-=SO32-+H2O,故B错误;
C.SO2具有还原性,ClO-离子具有氧化性,在溶液中反应应生成硫酸钙和Cl-离子,故C错误;
D.向硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀物质的量最多,应为Al3+全部转化为Al(OH)3沉淀,反应的离子方程式为3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓,故D正确;
故选D.
点评:本题考查离子方程式的正误判断,做题时注意物质的氧化性、还原性以及参加反应的物质的物质的量并以此判断反应的程度是做题的关键.
本题难度:一般
3、选择题 下列各组比较中,正确的是
A.原子半径K< Na
B.酸性H2CO3< H2SO4
C.稳定性HF< HCI
D.碱性NaOH< Mg(OH)2
参考答案:B
本题解析:试题分析:同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,氢化物的稳定性逐渐减弱,A不正确,原子半径K>Na,C不正确,稳定性HF>HCI;非金属性越强,最高价氧化物的水化物的酸性越强,则酸性H2CO3<H2SO4,B正确;同周期自左向右金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐减弱,D不正确,碱性NaOH>Mg(OH)2,答案选B。
考点:考查元素周期律的应用
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:简单
4、选择题 250C时,向VmLpH=a的盐酸中滴加pH=b的氢氧化钠溶液10VmL时,溶液中
Cl-的物质的量恰好等于Na+的物质的量,则此时a+b的值为
A.13
B.14
C.15
D.不能确定
参考答案:A
本题解析:试题分析:溶液中Cl-的物质的量恰好等于Na+的物质的量,说明恰好酸碱完全反应,则反应的H+的物质的量等于OH-的物质的量,则10-amol/L·VmL·10-3=10-(14-b)mol/L·10VmL·10-3计算可得a+b=13,故选A。
考点:酸碱滴定反应的计算
点评:本题考查强酸强碱的反应,通过物质的量相等即可建立等式,难度不大。
本题难度:简单
5、选择题 下列各组分子中,都由极性键构成的极性分子的一组是
A.H2O和NH3
B.CCl4和H2S
C.C2H2和CO2
D.H2O2和CS2
参考答案:A
本题解析:试题分析:由同种原子构成的共价键是非极性键,不同种原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子。以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子。A、H2O分子中含有极性键,空间结构为V型,正负电荷的中心不重合,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故A正确;B、CCl4分子中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;H2S中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故B错误;C、C2H2分子中含有极性键和非极性键,但结构对称,正负电荷的中心重合,属于非极性分子;CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故C错误;D、H2O2中含有极性键和非极性键,但结构不对称,正负电荷的中心不重合,属于极性分子;CS2中含有极性键和非极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故D错误,答案选A。
考点:考查极性键与非极性键;极性分子与非极性分子的判断
本题难度:困难