微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列反应中水既不作氧化剂也不作还原剂的氧化还原反应的是
A.氟气溶于水
B.金属钠溶于水
C.过氧化钠溶于水
D.电石溶于水
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;
HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
[? ]
A.Fe3+
B.MnO4-
C.Cl2
D.HNO2
参考答案:B
本题解析:
本题难度:一般
3、计算题 向8?g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100?mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224?mL(标准状况)氧气,在另一个电极上析出该金属1.28?g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后硫酸溶液的物质的量浓度(假设溶液体积不变)。
参考答案:(1)氧化铜
(2)c(H2SO4)=0.2mol/L
本题解析:
本题难度:一般
4、计算题 在25℃时,用石墨电极电解2.0L 2.5mol/L CuSO4溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
(1)转移电子的物质的量,得到O2的体积(标准状况),溶液的pH?
(2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的pH是否变化? (相对原子质量 Cu:64)
参考答案:
(1)设转移电子的物质的量为x ,生成氧气的体积为V
2Cu2+ + 4e- = 2Cu
4 2
x 6.4g/(64g/mol)
4:x=2:0.1mol
x=0.2mol
根据电子守恒:
4OH- - 4e- = 2H2O + O2↑
4 4mol 22.4L
n(OH-) 0.2mol V
4mol:0.2mol =22.4L:V
V=1.12L
n(H+)=n(OH-)=0.2mol
c(H+)=0.2mol/2.0L=0.1mol/L
pH=-lgc(H+)=1
(2)用等质量的两块铜片代替石墨作电极,电极反应为: 阳极:Cu-2e-=Cu2+ 阴极:Cu2++2e-=Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,电解后两铜片的质量相差为: 6.4g+6.4g=12.8g,溶液中c(H+)不变,pH不变。
本题解析:
本题难度:一般
5、填空题 某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。?
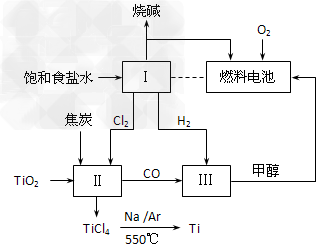
(1)?燃料电池中通入氧气的电极是___________(填“正”或“负”)极,电极反应式是____________;用该电池电解饱和食盐水,若消耗32?g甲醇,理论上Ⅰ中可生成NaOH?________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是___________;由TiCl4得到金属Ti的化学方程式是______________。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
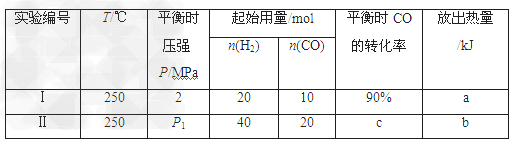
①?P1____________4MPa(填“>”、“<”或“=”);
②?实验Ⅰ条件下合成甲醇的热化学方程式是____________。?
参考答案:(1)正?;O2?+?4e-?+?2H2O?=?4OH-?;?6
(2)1﹕2?;4Na?+?TiCl4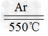 4NaCl?+?Ti
4NaCl?+?Ti
(3)①< ②?;CO(g)?+?2H2(g) CH3OH(g)?△H?=?kJ·mol-1
CH3OH(g)?△H?=?kJ·mol-1
本题解析:
本题难度:一般