|
高考化学知识点归纳《弱电解质电离平衡》高频考点巩固(2017年模拟版)(六)
2017-08-01 01:33:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
[? ]
A.c(CN-)>c(F-)
B.c(CN-)=c(F-) ?
C.NaCN水解程度比NaF大
D.NaCN电离程度比NaF大
参考答案:C
本题解析:
本题难度:一般
2、选择题 pH相同的氨水和NaOH溶液,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m和n的关系是
A.m<n
B.m=n
C.m>n
D.不能确定
|
参考答案:C
本题解析:氨水是弱碱溶液,氢氧化钠是强碱,pH相同的二者,氨水的浓度大于氢氧化钠溶液的浓度,若稀释相同的倍数,由于氨水的稀释会促进一水合氨的电离,所以稀释后的二者中,氨水的pH较大,若稀释后溶液的pH仍相同,则氨水的稀释倍数大于氢氧化钠溶液,则m>n,答案选C。
考点:考查溶液稀释规律
本题难度:一般
3、选择题 乙醇、液氨、水都可以发生自偶电离,如H2O+H2O?H3O++OH-,NH3+NH3?NH4++NH2-,则下列叙述正确的是( )
A.乙醇的电离方程式:2CH3CH2OH?CH3CH2OH2++CH3CH2O-
B.液氨的离子积常数为:1.0×10-28,则液氨浓度为1.0×10-14mol/L
C.若可用与pH相当的定义来规定pOH、pNH2-等,则乙醇中与pH相当的为-lgc(CH3CH2OH2+)
D.乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,则此时的p?CH3CH2O-=-15
参考答案:A、根据自偶的实质是分子结合另一分子的氢离子形成阳离子,另一分子形成阴离子发生电离,乙醇的电离方程式:2CH3CH2OH?CH3CH2OH2++CH3CH2O-,故A正确;
B、液氨的离子积常数为:1.0×10-28,离子积常数结合水的离子积常数写出:[NH4+][NH2-]=1.0×10-28,根据电离方程式可知:NH3+NH3?NH4++NH2-,:[NH4+]=[NH2-]=1.0×10-14mol/L,所以液氨浓度大于1.0×10-14mol/L,故B错误;
C、水溶液中pH=-lg[H+],pOH=-lg[OH-],可类推pPH是用电离出的阳离子浓度的负对数计算,乙醇中与pH相当的为-lgc(CH3CH2OH2+),故C正确;
D、乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,电离方程式为2CH3CH2OH?CH3CH2OH2++CH3CH2O-,得到c(CH3CH2OH2+)=c(CH3CH2O-)=1.0×10-15,此时的p?CH3CH2O-=-lg[1.0×10-15]=15,故D错误;
故选AC.
本题解析:
本题难度:一般
4、选择题 下列有关说法正确的是
A.0.1 mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D.0.1 mol/L的NaHA溶液,其pH=4: c(HA-) > c(H+)> c(H2A) > c(A2-)
参考答案:B
本题解析:A.NH4C1是强酸弱碱盐,在水溶液中水解使溶液显酸性。当加蒸馏水稀释,促进盐的水解,是水解平衡正向移动。由于稀释作用大于水解平衡的移动的影响,所以溶液的酸性减弱,pH不断增大。错误。B.常温下,pH=2的CH3COOH溶液,c(H+)=10-2mol/L.由于醋酸是弱酸,所以c(CH3COOH)> 10-2mol/L; pH=12的NaOH溶液,c(OH-)=10-2mol/L,因为NaOH是一元强碱,所以c(NaOH)= c(OH-)= 10-2mol/L。当二者等体积混合时,由于n(CH3COOH)>n(NaOH).所以溶液为NaAc与HAc的混合溶液。由于酸过量所以溶液显酸性,溶液的pH<7。正确。C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应。错误。D.0.1 mol/L的NaHA溶液,其pH=4:。说明HA-的电离作用大于其水解作用。在在溶液中除了存在HA-电离产生H+外,还存在H2O电离也产生H+。因此c(H+)> c(A2-) 。故 c(HA-) > c(H+)> c(A2-) >c(H2A) 。错误。
本题难度:一般
5、填空题 (18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=?kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:

写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中 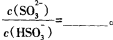 。 。
(常温下H2SO3的电离常数: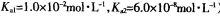 ) )
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。

①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH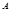 ___pH ___pH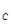 。(填 。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
参考答案:(l)—11601。(2)2NO2+4Na2SO3 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
本题解析:(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,根据盖斯定律:②×2—①,
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJ?mol-1。(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3 N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知, N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,  =Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。 =Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
本题难度:一般
|