微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示:
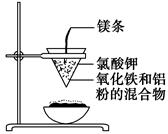
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
参考答案:(1)2Al+Fe2O3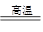 2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
本题解析:(1)铝热反应为2Al+Fe2O3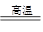 2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
(2)①②③④全为该铝热反应的现象。
(3)铝热反应实验中①为使熔融物易落下通常在内层纸漏斗底部剪一个孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙子;③反应中镁条引起氯酸钾分解;④氯酸钾引发铝热反应。
本题难度:简单
2、选择题 下列叙述正确的是( )
A.硅元素在自然界中以游离态存在
B.氨气是工业制取硝酸的重要原料
C.铝是金属,与强碱不能发生反应
D.陶瓷、玻璃、水泥都属于碳酸盐产品
参考答案:A、Si在自然界中的存在既有单质硅又有含硅的化合物,所以既有游离态又有化合态,故A错误;
B、氨气催化氧化可以获得一氧化氮,然后转化为二氧化氮,和水反应可以获得硝酸,氨气是工业制取硝酸的重要原料,故B正确;
C、金属铝既能和强酸反应又能和强碱反应,故C错误;
D、陶瓷、玻璃、水泥的主要成分中均含有硅酸盐,属于硅酸盐产品,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 同样条件下,将Mg、Al、Fe分别投入质量相等且足量的稀硫酸中,反应结束后,三种溶液质量仍相等,则投入的Mg、Al、Fe三种物质的质量关系正确的是?
A.Mg>Al>Fe
B.Al>Fe>Mg
C.Al>Mg>Fe
D.Fe>Mg>Al
参考答案:C
本题解析:设所加入的三种金属Mg、Al、Fe的质量分别为m1、m2、m3,
Mg→H2↑? 2Al→3H2↑? Fe→H2↑
24? 2? 27×2? 3×2? 56? 2
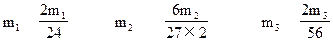
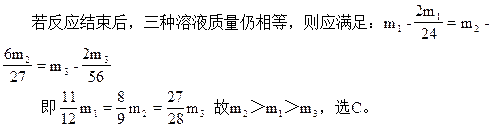
本题难度:一般
4、选择题 将铝粉和四氧化三铁粉末配成的铝热剂分成两等份:一份在高温下恰好反应,再与足量 稀硫酸反应,生成氢气a L;另一份直接放入足量的氢氧化钠溶液中充分反应,在相同条件下生成氢气b L,则a︰b为(?)
A.1:1
B.4:3
C.3:4
D.8:9
参考答案:C
本题解析:在第一种情况下 先发生反应 3Fe3O4+8Al=9Fe+4Al2O3然后Fe与H2SO4反应生成氢氧;第二捉情况铝直接发生反应2Al+2H2O+2NaOH=2NaAlO2+3H2生成氢气。由8Al~9Fe~9H2?8Al~12H2且二种情况中Al的初始量相等,所以得a︰b=3:4 选C
点评:本题属于常规考题,列方程式计算,关键在于利用物质的量之比等于化学方程式中计量数之比
本题难度:简单
5、选择题 设 为阿伏加德罗常数的值,下列叙述中正确的是( )
为阿伏加德罗常数的值,下列叙述中正确的是( )
A.92 g NO2和N2O4混合气体中含有的分子数为2
B.标准状况下,11.2 L SO3中含有的电子数为20
C.0.5 mol·L-1的Ba(OH)2溶液中OH-的数目为
D.1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2
参考答案:D
本题解析:A中存在2NO2N2O4,故分子数不确定。B中SO3在标准状况下为固体;C中没有溶液的体积。
本题难度:简单