微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有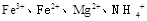 的溶液中,加入足量的
的溶液中,加入足量的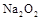 固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是
固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是
A.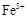
B.
C.
D.
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列离子方程式正确的是
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+
C.氢氧化镁溶于盐酸:Mg(OH)2+H+=Mg2++2H2O
D.碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O
参考答案:B
本题解析:
本题难度:简单
3、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+
B.强碱性溶液中:NH4+、NO3-、Ba2+、K+
C.澄清透明的溶液中:MnO4-、Al3+、SO42-、K+
D.含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN-
参考答案:C
本题解析:试题分析:A、甲基橙的变色范围3.1~4.4,溶液呈酸性,与NO3-构成强氧化性环境,Fe2+易被氧化,错误;B、NH4++OH- NH3↑+H2O,错误;C、此项极易理解错误,有色溶液也可以是透明溶液,错误;D、Fe3+与SCN-易形成Fe(SCN)3络合物,正确。
NH3↑+H2O,错误;C、此项极易理解错误,有色溶液也可以是透明溶液,错误;D、Fe3+与SCN-易形成Fe(SCN)3络合物,正确。
考点:考查离子共存。
本题难度:一般
4、选择题 下列各组离子因发生水解反应而不能大量共存的是
A.Ba2+、Cl-、Na+、SO42-
B.AlO2-、K+、HCO3-、Cl-
C.OH-、Fe3+、NO3-、SO42-
D.Al3+、Na+、HCO3-、Cl-
参考答案:D
本题解析:试题分析:A项Ba2+和SO42-因生成沉淀不能大量共存,B项AlO2-和HCO3-因为发生强酸制弱酸反应不能大量共存,C项OH-和Fe3+因为生成沉淀不能大量共存,D项Al3+和HCO3-因为发生双水解反应不能大量共存。答案选D。
考点:离子共存
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:困难
5、选择题 一种化学冰袋中含有Na2SO4·10H2O(96 g)、NH4NO3(50 g)、(NH4)2SO4(40 g)、NaHSO4(40 g).将Na2SO4·10H2O和其他3种盐分盛于2只塑料袋中,用时使它们混合并用手搓揉就可制冷,制冷效果能维持2~3h.以下关于其制冷原因的猜测肯定错误的是
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生复分解反应是吸热反应
D.NH4NO3溶于结晶水中会吸收热量
参考答案:C
本题解析:化学冰袋能够制冷的原因应该是在揉搓制冷的过程中发生了吸热反应或吸热变化,Na2SO4·10H2O在揉搓的过程中脱水,NH4NO3溶于结晶水中会吸收热量,较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程,因此,A、B、D正确.Na2SO4·10H2O、NH4NO3、(NH4)2SO4、NaHSO4之间不会发生复分解反应,所以C错误.
本题难度:困难