微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
[? ]
A.电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
2、选择题 下列实验操作或装置符合实验要求的是
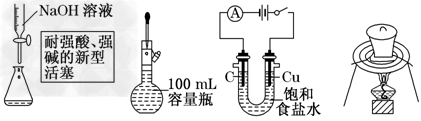
[? ]
A.量取15.00?mL?NaOH溶液
B.定容
C.电解制Cl2和H2
D.高温煅烧石灰石
3、实验题 食盐是日常生活的必需品,也是重要的化工原料。
Ⅰ?粗食盐常含有少量K+、Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下
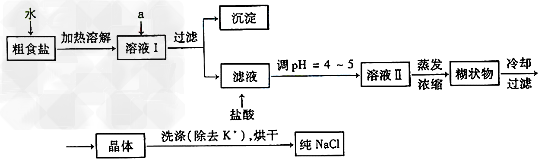
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液?NaOH溶液?BaCl2溶液? ?Ba(NO3)2溶液?75%乙醇?四氯化碳?冷水
① 欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
____________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为__________________。
③在整个实验过程中,下列实验装置不可能用到的是_____________(填序号)。

④【有关资料】
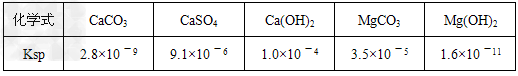
溶液Ⅰ中加入试剂a,只要控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时滤液中Mg2+物质的量浓度将被控制在__________以下。
Ⅱ?我国化学工程专家侯德榜创立的侯氏制碱法,食盐是其中的主要原料。实验室根据侯氏制碱法并参考下表数据,制备纯碱的主要步骤是:将配置好的NaCl饱和溶液倒入烧杯中加热,控制一定温度范围,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30min,静置、过滤得晶体NaHCO3。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2h,制得Na2CO3固体。
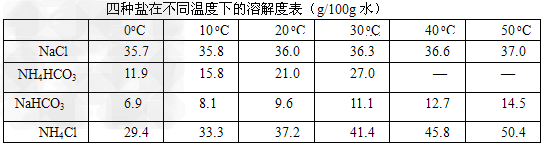
※ 温度高于35℃,NH4HCO3会有分解请回答:该反应的方程式:_________________
操作过程中反应温度控制在30℃?<t<_______为控制此温度范围,采取的加热方式为________________。
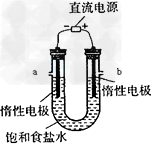
Ⅲ?电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2?________?(填“>”、“=”或?“<”)2L,原因是___________________?。装置改进后,可用于制备NaOH溶液,若测定溶液中 NaOH的浓度,常用的方法为________________。装置b口出来气体的检验方法:_______________________。
4、选择题 从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;?②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;?③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;?④将得到的产物熔融电解得到镁.下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取镁盐
C.①②③步骤涉及化合、分解和复分解反应
D.第①到第④步的反应都是氧化还原反应
5、选择题 火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时
[? ]
A.粗铜接电源负极
B.纯铜做阳极
C.杂质都将以单质形式淀沉到池底
D.纯铜片增重2.56 g,电路通过电子为0.08 mol