微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)组成一种原电池如图所示。试回答下列问题(灯泡功率合适):
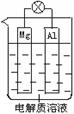
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填“不亮”做②题) 。
。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____?(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
参考答案:(1)亮,①Mg—2e-=Mg2+;2H++2e-=H2↑。(2)亮,①Al-3e-+4OH-=AlO2-+2H2O。
本题解析:略
本题难度:简单
2、填空题 ( 12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
参考答案:(1)1:1
(2)As2S3 氢氧化钠溶液或硫酸铜溶液
(3)10mol 正极
(4)a
本题解析:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,As的化合价降低1价,As2S3整体降低2价,Sn的化合价升高2价,根据化合价升降总数相等,As2S3和SnCl2的物质的量之比为1:1;
(2)氧化剂中元素化合价降低,所以As2S3作氧化剂;硫化氢与氢氧化钠溶液反应生成硫化钠和水,也与硫酸铜溶液反应生成硫化铜和硫酸,所以产生的硫化氢气体可用氢氧化钠溶液或硫酸铜溶液吸收;
(3)生成2mol H3AsO4时有10mol的二氧化氮生成,该反应中只有硝酸根离子被还原,所以转移的电子的物质的量是10mol;
(4)11.2L的氧气的物质的量是0.5mol,生成的硝酸的物质的量是2mol,则浓硝酸与C反应生成的二氧化碳的物质的量理论上是0.5mol,但二氧化碳溶于水,所以最终产生的二氧化碳的物质的量小于0.5mol,答案选a。
考点:考查对氧化还原反应的分析、计算
本题难度:一般
3、选择题 蓄电池是能反复充电和放电的二次化学电池。有一种蓄电池在充电和放电时发生的反应是:
NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2,下列有关该电池的说法正确的是
Fe(OH)2+Ni(OH)2,下列有关该电池的说法正确的是
[? ]
A.此蓄电池放电时,某一电极发生还原反应的物质是Fe
B.此蓄电池充电时,应将电池的“+”极连电源的负极
C.放电时电池的负极反应是:Fe-2e-+2H2O=Fe(OH)2+2H+
D.电池消耗2 mol H2O时,反应中转移2 mol电子
参考答案:D
本题解析:
本题难度:一般
4、填空题 现有A,B两种金属分别与盐酸反应,产生氢气的速率相近。请设计一个原电池实验来证明A,B两种金属的活动性?____________________________________
参考答案:将A,B两种金属片用导线连接放入盐酸中组成原电池,有气泡逸出的是较不活泼的金属,另一极即是活泼的金属
本题解析:
本题难度:一般
5、选择题 镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是
A.镁条作负极,电极反应:Mg-2e-=Mg2+
B.铝片作负极,电极反应:Al+4OH--3e--=AlO2-+2H2O
C.电流从Al电极沿导线流向Mg电极
D.铝片上有气泡产生