| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《水的电离平衡》在线测试(2017年最新版)(八)
参考答案:D 本题解析:氯气即不是电解质也不是非电解质,排除;二氧化碳为非电解质,排除;碘化钾溶于水后,不能破坏水的电离平衡,排除;而醋酸钠为盐,属于电解质,并且可水解促进水的电离,选D 本题难度:一般 2、选择题 下列电离方程式书写正确的是 参考答案:C 本题解析: 本题难度:简单 3、填空题 (14分)现有常温下的六份溶液: 参考答案:(1)⑥,②③④ ;(2)> > > ;(3)>, >;(4)①否 AB ;②c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。 本题解析:(1)①②③④是酸或碱对水的电离起抑制作用,⑤NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥的水的电离最大,②③④溶液中c(H+)或c(OH-)相等,对水的电离影响相同;(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥;(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-);(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;②在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。 本题难度:困难 4、选择题 已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是 |
参考答案:B
本题解析:A.没有温度,pH="7" 的溶液不一定的中性溶液,错误;B.根据[H+]×[OH-]=Kw,可得混合溶液中,c(H+)= mol/L的溶液一定是中性溶液,正确;C.a=b,则酸碱恰好反应,溶液可能中性、酸性、或碱性,错误;D.任何溶液中都存在电荷守恒,错误;选B。
mol/L的溶液一定是中性溶液,正确;C.a=b,则酸碱恰好反应,溶液可能中性、酸性、或碱性,错误;D.任何溶液中都存在电荷守恒,错误;选B。
考点:考查溶液的酸碱性。
本题难度:一般
5、填空题 (18分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是 装置①的作用是
(2)装置②中制备ClO2的化学方程式为 ;产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果 (填“偏高”或“偏低”),原因用离子方程式表示为 。
参考答案:(1)防止倒吸;吸收装置中未反应的ClO2 ,防止外逸污染空气;
(2)Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O; Na2SO3;
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑(2分) ;
(3)用38 ℃~60 ℃的温水洗涤;(4)溶液由蓝色变为无色且半分钟不变色
(5)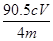 % 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
% 或 22.6Cv/m% (2分),(6)偏高 4I-+O2+4H+=2I2+2H2O (2分)
本题解析:(1)在装置②中发生反应制取ClO2,在装置④中气体进行反应,使装置内压强降低,装置③防止倒吸现象的发生;装置①中含有NaOH溶液,可以与ClO2,发生反应,因此其作用是吸收装置中未反应的ClO2 ,防止外逸污染空气;(2)在装置②中发生反应制取ClO2,根据电子守恒和质量守恒定律可得:Na2SO3+2NaClO3+H2SO4= 2Na2SO4+ 2ClO2↑+H2O。在该反应中Na2SO3中的S元素的化合价升高,失去电子,作还原剂;在装置④ClO2与NaOH的H2O2溶液发生氧化还原反应,产生反应后的溶液获得NaClO2晶体,在该反应中Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,根据电子守恒、原子守恒可得方程式为: 2NaOH+ 2ClO2+ H2O2= 2NaClO2+2H2O+O2,(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2·3H2O,应趁热过滤,由题目信息可知,应该控制温度38℃~60℃进行洗涤,低于60℃干燥;(4)碘单质遇淀粉变蓝色,反应结束时,碘反应完全,所以滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;(5)令样品中NaClO2的质量分数为a,根据反应方程式:ClO2-+4I-+4H+=2H2O+2I2+Cl-;I2+2S2O32-=2I-+S4O62-可得关系式:NaClO2~2I2~4S2O32-。则NaClO2与S2O32-的关系是每90.5g NaClO2对应消耗 4mol 的S2O32-。n(S2O32-)=" c" mol·L-1×V×10-3L×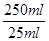 ,则m(NaClO2)=
,则m(NaClO2)= 。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=
。所以NaClO2的纯度是a= [m(NaClO2)÷m(总)]×100=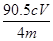 %=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
%=22.6Cv/m%。(6)(6)在滴定操作正确无误的情况下,由于反应过程会产生氧气,氧气会将溶液中的I-氧化为I2单质,使溶液中碘的含量偏高,滴定消耗的Na2S2O3标准液体积偏高,故会使实验测得结果偏高。反应离子方程式为4I-+O2+4H+=2I2+2H2O。
考点:考查物质制取过程中装置的作用、物质制取原理的方程式表示、滴定终点的判断、误差分析、关系式法在物质纯度的计算中的作用的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《氧化还原反.. | |